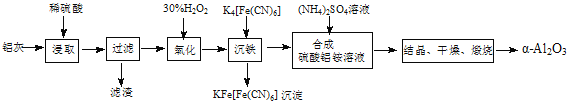
题目内容
【题目】(1)在一定条件,可逆反应:mA+nB![]() pC达到平衡状态。
pC达到平衡状态。
①若A、C是气体,而且m+n=p,减小压强可使平衡发生移动,则平衡向____________(填“正”或“逆”)反应方向移动。
②若A、B、C均为气体,且m+n<p,加热后,可使混合气体平均摩尔质量增加,则正反应是____________(填“吸热”或“放热”)反应。
③若在反应过程中,C的物质的量n(C)随时间的变化关系如图所示(从t1时间开始对反应体系升高温度)。则a、b两点的正反应速率:v(a)____________v(b)(填“>”、“<”或“=”);

(2)Na2CO3溶液呈碱性,其原因是(用离子方程式表示)___________________;由同浓度的Na2CO3和NaHCO3组成的混合溶液中离子浓度由大到小的顺序为____________________;
(3)某温度下,纯水的c(H+)=3×10-7mol/L,Na2S和NaOH两溶液的pH均为12,则两溶液中由水电离出的c(H+)的比值为_________________;
【答案】
(1)①正;②放热;③<;
(2)CO32-+H2O![]() HCO3-+OH-;c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+);
HCO3-+OH-;c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+);
(3)9×1010或9×1010:1;
【解析】
试题分析:(1)①因增大压强,平衡向气体体积减小的方向移动,A、C是气体,而且m+n=p,所以B不是气体,则m<p,即平衡移动的方向是逆反应方向,故答案为:逆;
②若A、B、C均为气体,且m+n<p,加热后,可使混合气体平均摩尔质量增加,即平衡逆向移动,所以该反应的正反应为放热反应,故答案为:放热;
③a点温度小于b点温度,温度升高,反应速率增大,故答案为:<;
(2)Na2CO3是强碱弱酸盐,CO32-水解导致溶液呈碱性,水解离子方程式为CO32-+H2O![]() HCO3-+OH-;相同浓度的Na2CO3和NaHCO3组成的混合溶液中,HCO3-水解程度小于CO32-,则c(HCO3-)>c(CO32-),钠离子不水解,但其水解程度都较小,所以离子浓度大小顺序是c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),故答案为:CO32-+H2O
HCO3-+OH-;相同浓度的Na2CO3和NaHCO3组成的混合溶液中,HCO3-水解程度小于CO32-,则c(HCO3-)>c(CO32-),钠离子不水解,但其水解程度都较小,所以离子浓度大小顺序是c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),故答案为:CO32-+H2O![]() HCO3-+OH-;c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+);
HCO3-+OH-;c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+);
(3)在测得pH都等于12的NaOH溶液和Na2S溶液中,NaOH溶液由水电离的OH-浓度为=10-12mol/L,Na2S溶液由水电离的OH-浓度为=![]() =9×10-2mol/L,故两者比值为9×10-2:10-12mol=9×1010。
=9×10-2mol/L,故两者比值为9×10-2:10-12mol=9×1010。

 名校课堂系列答案
名校课堂系列答案