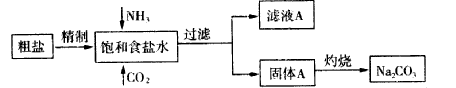
题目内容
下列各组中的两物质相互反应时,若改变反应条件(温度、反应物用量比),化学反应并不改变的是
| A.Al和氢氧化钠溶液 | B.NaOH和CO2 |
| C.Na和O2 | D.AlCl3和NaOH |
A
试题分析:A、金属铝与氢氧化钠溶液反应生成物是偏铝酸钠和氢气,与温度、反应物用量无关系,A正确;B、足量的CO2与氢氧化钠溶液反应生成碳酸氢钠,足量的氢氧化钠与CO2反应生成碳酸钠和水,与反应物的用量有关系,B不符合题意;C、钠与氧气在常温下反应生成氧化钠,加热时则生成过氧化钠,与温度有关系,C不符合题意;D、氯化铝与少量的氢氧化钠溶液反应生成氢氧化铝和氯化钠,与足量的氢氧化钠溶液反应生成偏铝酸钠、氯化钠和水,与反应物的用量有关系,D不符合题意,答案选A。

练习册系列答案
 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案
相关题目