题目内容
向某NaOH溶液中通人CO2气体后得溶液M,因CO2通入量的不同,溶液M的组成也不同.若向M中逐滴加人盐酸,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)的关系有下列图示四种情况,且(2)中有OA<AB,(3)中有OA=AB,(4)中有OA>AB,则下列分析与判断不正确的是(不计CO2的溶解)
- A.图(1)显示M中一定有:c(Na+)>c(HCO3-)>c(OH-)>c(H2CO3)>c(CO32-)
- B.图(2)显示M中一定有:c(NaHCO3)>c(Na2CO3)
- C.图(3)显示M中一定有:c(Na+)=c(HCO3-)+2c(CO32-)+c(OH-)-c(H+)
- D.图(4)显示M中的溶质是:NaOH和Na2CO3
B
分析:CO2与NaOH反应为①CO2+NaOH=NaHCO3,②CO2+2NaOH=Na2CO3+H20,
当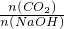 ≥1,反应按①进行,等于1时,CO2、NaOH恰好反应生成NaHCO3;大于1时,生成生成NaHCO3,CO2有剩余;
≥1,反应按①进行,等于1时,CO2、NaOH恰好反应生成NaHCO3;大于1时,生成生成NaHCO3,CO2有剩余;
当 <
<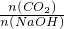 <1,反应按①②进行,CO2、NaOH反应,无剩余,生成物为NaHCO3、Na2CO3;
<1,反应按①②进行,CO2、NaOH反应,无剩余,生成物为NaHCO3、Na2CO3;
当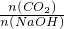 ≤
≤ ,反应按②进行,等于
,反应按②进行,等于 时,CO2、NaOH恰好反应生成Na2CO3;小于
时,CO2、NaOH恰好反应生成Na2CO3;小于 时,生成Na2CO3,NaOH有剩余;
时,生成Na2CO3,NaOH有剩余;
向M中逐滴加入盐酸,根据溶液M中溶质不同,通过反应过程判断;
解答:由分析可知向NaOH溶液中通入CO2气体后得溶液M中溶质情况有:
(1)当含有两种溶质时,
①若溶质为Na2CO3、NaOH时,不能立即产生气体,滴加盐酸先中和氢氧化钠,然后与碳酸钠反应生成碳酸氢钠,碳酸氢钠再与盐酸发生反应生成二氧化碳,且与碳酸钠反应生成碳酸氢钠消耗盐酸体积同碳酸氢钠与盐酸反应生成二氧化碳所消耗的盐酸体积相等,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)的关系为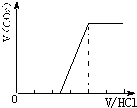 ;
;
②若为NaHCO3、Na2CO3,不能立即产生气体,滴加盐酸先与碳酸钠反应生成碳酸氢钠,碳酸氢钠再与盐酸发生反应生成二氧化碳,且与碳酸钠反应生成碳酸氢钠消耗盐酸体积小于与碳酸氢钠反应生成二氧化碳所消耗的盐酸体积,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)的关系为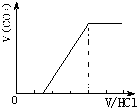 ;
;
(2)若只有一种溶质时,
①当溶质为Na2CO3时,不能立即产生气体,滴加盐酸先与碳酸钠反应生成碳酸氢钠,碳酸氢钠再与盐酸发生反应生成二氧化碳,且与碳酸钠反应生成碳酸氢钠消耗盐酸体积等于与碳酸氢钠反应生成二氧化碳所消耗的盐酸体积,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)的关系为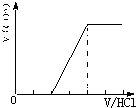 ;
;
②当溶质为NaHCO3时,滴加盐酸与碳酸氢钠反应生成二氧化碳,立即产生气体,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)的关系为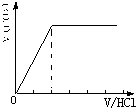 .
.
A、由上述分析可知,图(1)显示M中只有NaHCO3,碳酸氢根离子的水解大于电离,故c(Na+)>c(HCO3-)>c(OH-)>c(H2CO3)>c(CO32-),故A正确;
B、由上述分析可知,图(1)显示M中NaHCO3、Na2CO3,且NaHCO3的物质的量大于Na2CO3,则c(NaHCO3)<c(Na2CO3),故B错误;
C、由上述分析可知,图(1)显示M中只有Na2CO3,根据质子守恒可知:c(Na+)=c(HCO3-)+2c(CO32-)+c(OH-)-c(H+),故C正确;
D、由上述分析可知,图(1)显示M中有Na2CO3、NaOH,故D正确.
故选:B;
点评:本题考查学生金属钠的化合物的性质,可根据碳酸钠、碳酸氢钠、氢氧化钠分别与盐酸反应的化学方程式来计算,注意量的关系.
分析:CO2与NaOH反应为①CO2+NaOH=NaHCO3,②CO2+2NaOH=Na2CO3+H20,
当
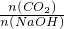 ≥1,反应按①进行,等于1时,CO2、NaOH恰好反应生成NaHCO3;大于1时,生成生成NaHCO3,CO2有剩余;
≥1,反应按①进行,等于1时,CO2、NaOH恰好反应生成NaHCO3;大于1时,生成生成NaHCO3,CO2有剩余;当
 <
<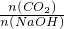 <1,反应按①②进行,CO2、NaOH反应,无剩余,生成物为NaHCO3、Na2CO3;
<1,反应按①②进行,CO2、NaOH反应,无剩余,生成物为NaHCO3、Na2CO3;当
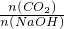 ≤
≤ ,反应按②进行,等于
,反应按②进行,等于 时,CO2、NaOH恰好反应生成Na2CO3;小于
时,CO2、NaOH恰好反应生成Na2CO3;小于 时,生成Na2CO3,NaOH有剩余;
时,生成Na2CO3,NaOH有剩余;向M中逐滴加入盐酸,根据溶液M中溶质不同,通过反应过程判断;
解答:由分析可知向NaOH溶液中通入CO2气体后得溶液M中溶质情况有:
(1)当含有两种溶质时,
①若溶质为Na2CO3、NaOH时,不能立即产生气体,滴加盐酸先中和氢氧化钠,然后与碳酸钠反应生成碳酸氢钠,碳酸氢钠再与盐酸发生反应生成二氧化碳,且与碳酸钠反应生成碳酸氢钠消耗盐酸体积同碳酸氢钠与盐酸反应生成二氧化碳所消耗的盐酸体积相等,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)的关系为
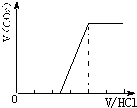 ;
;②若为NaHCO3、Na2CO3,不能立即产生气体,滴加盐酸先与碳酸钠反应生成碳酸氢钠,碳酸氢钠再与盐酸发生反应生成二氧化碳,且与碳酸钠反应生成碳酸氢钠消耗盐酸体积小于与碳酸氢钠反应生成二氧化碳所消耗的盐酸体积,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)的关系为
 ;
;(2)若只有一种溶质时,
①当溶质为Na2CO3时,不能立即产生气体,滴加盐酸先与碳酸钠反应生成碳酸氢钠,碳酸氢钠再与盐酸发生反应生成二氧化碳,且与碳酸钠反应生成碳酸氢钠消耗盐酸体积等于与碳酸氢钠反应生成二氧化碳所消耗的盐酸体积,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)的关系为
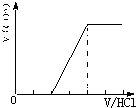 ;
;②当溶质为NaHCO3时,滴加盐酸与碳酸氢钠反应生成二氧化碳,立即产生气体,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)的关系为
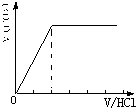 .
.A、由上述分析可知,图(1)显示M中只有NaHCO3,碳酸氢根离子的水解大于电离,故c(Na+)>c(HCO3-)>c(OH-)>c(H2CO3)>c(CO32-),故A正确;
B、由上述分析可知,图(1)显示M中NaHCO3、Na2CO3,且NaHCO3的物质的量大于Na2CO3,则c(NaHCO3)<c(Na2CO3),故B错误;
C、由上述分析可知,图(1)显示M中只有Na2CO3,根据质子守恒可知:c(Na+)=c(HCO3-)+2c(CO32-)+c(OH-)-c(H+),故C正确;
D、由上述分析可知,图(1)显示M中有Na2CO3、NaOH,故D正确.
故选:B;
点评:本题考查学生金属钠的化合物的性质,可根据碳酸钠、碳酸氢钠、氢氧化钠分别与盐酸反应的化学方程式来计算,注意量的关系.

练习册系列答案
相关题目

 向某NaOH溶液中通入CO2气体后得溶液M,因CO2通入量的不同,溶液M的组成也不同.若向M中逐滴加入盐酸,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)的关系有下列图示四种情况,且(2)、(3)、(4)图中分别为OA<AB,OA=AB,OA>AB,则下列分析与判断正确的是(不计CO2的溶解)( )
向某NaOH溶液中通入CO2气体后得溶液M,因CO2通入量的不同,溶液M的组成也不同.若向M中逐滴加入盐酸,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)的关系有下列图示四种情况,且(2)、(3)、(4)图中分别为OA<AB,OA=AB,OA>AB,则下列分析与判断正确的是(不计CO2的溶解)( )
