题目内容
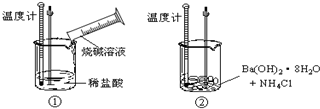
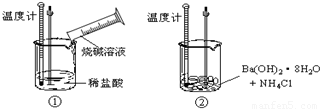
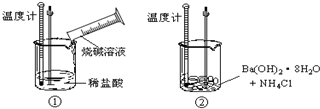
(1)化学式为C8Hm的烷烃,m值等于 ;CnH22的烷烃,n值等于 .(2)某同学进行如下实验,探究化学反应中的能量变化.通过实验测出,反应前后①烧杯中的温度升高,②烧杯中的温度降低.由此判断NaOH溶液跟盐酸的反应是 (填“吸热”或“放热”)反应,Ba(OH)2?8H2O跟NH4Cl的反应是 (填“吸热”或“放热”)反应.试写出①中反应的离子方程式 .
【答案】分析:(1)根据烷烃的通式CnH2n+2来计算;
(2)根据温度升高,反应放热,温度降低、反应吸热;根据化学方程式书写离子方程式.
解答:解:(1)由烷烃的通式CnH2n+2得,化学式为C8Hm的烷烃m=2×8+2=18;CnH22的烷烃22=n×2+2,即n=10,故答案为:18;10;
(2)因温度升高,反应放热,温度降低、反应吸热,所以NaOH溶液跟盐酸的反应是放热反应,Ba(OH)2?8H2O跟NH4Cl的反应是吸热反应,NaOH溶液跟盐酸反应方程式为:HCl+NaOH=NaCl+H2O,故答案为:放热;吸热;H++OH-=H2O.
点评:本题考查了烷烃的通式、根据实验现象判断放热与吸热反应,难度不大,根据课本即可完成.
(2)根据温度升高,反应放热,温度降低、反应吸热;根据化学方程式书写离子方程式.
解答:解:(1)由烷烃的通式CnH2n+2得,化学式为C8Hm的烷烃m=2×8+2=18;CnH22的烷烃22=n×2+2,即n=10,故答案为:18;10;
(2)因温度升高,反应放热,温度降低、反应吸热,所以NaOH溶液跟盐酸的反应是放热反应,Ba(OH)2?8H2O跟NH4Cl的反应是吸热反应,NaOH溶液跟盐酸反应方程式为:HCl+NaOH=NaCl+H2O,故答案为:放热;吸热;H++OH-=H2O.
点评:本题考查了烷烃的通式、根据实验现象判断放热与吸热反应,难度不大,根据课本即可完成.

练习册系列答案
相关题目
 (1)化学式为C8Hm的烷烃,m值等于
(1)化学式为C8Hm的烷烃,m值等于