题目内容
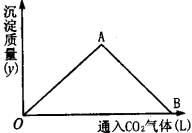
下图为一定量饱和Ca(OH)2溶液中通入二氧化碳气体后,产生CaCO3白色沉淀的质量与二氧化碳体积之间的关系曲线。试完成下列问题:
OA段曲线和AB段曲线所表示的反应方程式是
OA:_______________________________________________________________;
AB:________________________________________________________________。
A点时已参加反应的CO2和Ca(OH)2的物质的量之比为_______________。
B处溶液中存在的浓度较大的两种离子是_____________和_____________(填离子符号)。
将B处生成的溶液煮沸,可见到的现象是______________________________。
解析:这是一道涉及碳酸正盐和碳酸氢盐互变规律的试题。如果能把握住下述规律,解题就会变得轻而易举。
(1)碳酸的正盐与过量的CO2反应时生成碳酸氢盐。
(2)碳酸氢盐与碱反应时生成碳酸的正盐和水。
(3)碳酸氢盐在加热条件下生成碳酸正盐、水和CO2。
OA段曲线表示在Ca(OH)2饱和溶液中,随着CO2通入量的增加,生成的CaCO3沉淀逐渐增多。其发生的化学反应为:
Ca(OH)2+CO2![]() CaCO3↓+H2O ①
CaCO3↓+H2O ①
AB段曲线表示CaCO3沉淀不断地与CO2发生化学反应,生成了易溶于水的碳酸氢盐。其发生的化学反应为:
CaCO3+CO2+H2O![]() Ca(HCO3)2 ②
Ca(HCO3)2 ②
由①式可知,在A点的物质体系中只有CaCO3和水,参加反应的CO2和Ca(OH)2的物质的量比为1∶1。
由②式可知,在B处的物质体系中是Ca(HCO3)2溶液,其中浓度较大的两种离子是Ca2+和![]() 。
。
如果将B处的溶液煮沸,则会有白色沉淀生成:
Ca(HCO3)2![]() CaCO3↓+H2O+CO2↑
CaCO3↓+H2O+CO2↑
答案:Ca(OH)2+CO2![]() CaCO3↓+H2O
CaCO3↓+H2O
CaCO3+CO2+H2O![]() Ca(HCO3)2
Ca(HCO3)2
1∶1 Ca2+ ![]() 有白色沉淀生成
有白色沉淀生成