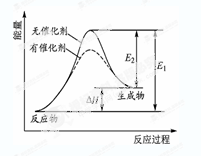
题目内容
 反应过程的能量变化如图所示。已知l mol SO2(g)氧化为1 molSO3 (g)的
反应过程的能量变化如图所示。已知l mol SO2(g)氧化为1 molSO3 (g)的 。请回答下问题;
。请回答下问题;
(1)E表示___________________;E的大小对该反应的反应热__________(填“有”或“无”)影响。
(2)该反应通常用V2O5作催化剂,加V2O5会使图中△H___________(填“变大”、“变小”或“不变”),理由是________。
(3)已知单质硫的燃烧热为296 kJ·mol
 ,计算由S(s)生成2mol SO3(g)的△H =________________。
,计算由S(s)生成2mol SO3(g)的△H =________________。(4)在一定条件下向容积为2L的容器中通入4molSO2和3molO2,充分反应达平衡后,SO3的体积分数为1/3。若在相同的条件下向容积为2L的容器中通入amolSO2和,bmolSO3,和cmol,反应向逆反应方向进行且达到平衡时SO3的体积分数也为1/3。则c的取值范围为___________。
(1)活化能;无(2)不变;因为催化剂可以降低反应的活化能但不能改变反应物和生成物的总能量,故不改变反应热;(3)-1185kJ/mol(4)2mol<c<4mol
试题分析:(1)根据能量变化图可知,E表示正反应的活化能,而反应热只与反应物和生成物的总能量有关,与活化能无关;(2)催化剂能够降低反应的活化能但不能改变反应物的总能量,故△H的大小与是否使用催化剂无关;(3)因为单质硫的燃烧热为296kJ?mol-1,热化学方程式为①S(s)+O2(g)=SO2(g)△H=-296kJ?mol-1,②2SO2(g)+O2(g)=2SO3(g)△H=-198kJ?mol-1;依据盖斯定律①×2+②得到 2S(s)+3O2(g)=2SO3(g)△H=-1185kJ/mol,即由S(s)生成2molSO3(g)的焓变为-1185kJ/mol;(4)利用等效平衡理论分析判断。

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目


 FeS
FeS