题目内容
【题目】钨是熔点最高的金属,是重要的战略物资。自然界中黑钨矿的主要成分是FeWO4、MnWO4,还含有少量Si、P、As的化合物。由黑钨矿制备WO3的工艺流程如图:
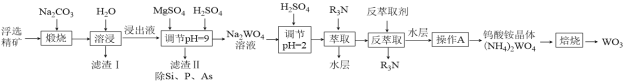
已知:①滤渣I的主要成份是Fe2O3、Mn3O4。
②萃取剂为叔胺N235,化学式用R3N表示,是一种弱碱。
回答下列问题:
(1)钨酸盐(FeWO4、MnWO4)中钨元素的化合价是_________,“煅烧”过程中生成Mn3O4的化学方程式是________________________________________________。
(2)溶浸时,固体要进行粉碎,同时还要不断搅拌的目的是______________________________。
(3)浸出液中的溶质有Na2WO4、Na2SiO3、Na3PO4、Na3AsO4,加入MgSO4、H2SO4将溶液的pH调至9时,溶液中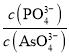 =_________。已知Ksp[Mg3(PO4)2]=2.0×10-24、Ksp[Mg3(AsO4)2] =2.0×10-20。
=_________。已知Ksp[Mg3(PO4)2]=2.0×10-24、Ksp[Mg3(AsO4)2] =2.0×10-20。
(4)“调节pH=2”时,钨酸钠(Na2WO4)转化为偏钨酸钠(Na6H2W12O40)的离子方程式是
12WO42-+ 18H+![]() H2W12O406-+ 8H2O。萃取过程发生反应是3(R3NH)2SO4(油层)+ H2W12O406-(水层)
H2W12O406-+ 8H2O。萃取过程发生反应是3(R3NH)2SO4(油层)+ H2W12O406-(水层)![]() (R3NH)6H2W12O40(油层)+ 3SO42-(水层),则反萃取获得(NH4)2WO4溶液时的反萃取剂可选择________。
(R3NH)6H2W12O40(油层)+ 3SO42-(水层),则反萃取获得(NH4)2WO4溶液时的反萃取剂可选择________。
A.氨水 B.NaOH溶液 C.NH4HCO3溶液 D.NH4Cl溶液
(5)操作A的名称是__________,焙烧生成WO3的化学方程式是_______________________。
【答案】+6 6MnWO4 + 6Na2CO3 + O2![]() 6Na2WO4 + 2Mn3O4 + 6CO2 增大固体与水的接触面积,加快溶解速率,使固体充分溶解,提高原料的利用率 10-2 AC 蒸发浓缩、冷却结晶、过滤洗涤(干燥) (NH4)2WO4
6Na2WO4 + 2Mn3O4 + 6CO2 增大固体与水的接触面积,加快溶解速率,使固体充分溶解,提高原料的利用率 10-2 AC 蒸发浓缩、冷却结晶、过滤洗涤(干燥) (NH4)2WO4![]() WO3+2NH3↑+H2O
WO3+2NH3↑+H2O
【解析】
由黑钨矿冶炼钨的工艺流程:向黑钨矿中[主要成分是铁和锰的钨酸盐(FeWO4、MnWO4)],还含少量Si、P、As的化合物)中加入Na2CO3,在空气中煅烧,主要反应为:6MnWO4 + 6Na2CO3 + O2![]() 6Na2WO4 + 2Mn3O4 + 6CO2、4FeWO4 + 4Na2CO3 + O2
6Na2WO4 + 2Mn3O4 + 6CO2、4FeWO4 + 4Na2CO3 + O2![]() 4Na2WO4 + 2Fe2O3+ 4CO2,加水溶解后再过滤,所得滤渣I的主要成份是不溶于水的Fe2O3和Mn3O4,滤液中除Na2WO4 外,还含有少量Na2SiO3、Na3PO4、Na3AsO4,向滤液中加入MgSO4溶液,并滴加稀硫酸调节溶液pH=9左右,除去不溶物,得到含有MgSiO3、MgHPO4、MgHAsO4的滤渣Ⅱ,滤液主要是含Na2WO4的溶液,再加入稀硫酸调节pH=2并依次用R3N萃取除去水层后,再加入反萃取剂获得(NH4)2WO4的水溶液,经蒸发浓缩、冷却结晶、过滤洗涤(干燥)即可得到(NH4)2WO4晶体,最后将所得晶体焙烧即得到WO3,据此分析解题。
4Na2WO4 + 2Fe2O3+ 4CO2,加水溶解后再过滤,所得滤渣I的主要成份是不溶于水的Fe2O3和Mn3O4,滤液中除Na2WO4 外,还含有少量Na2SiO3、Na3PO4、Na3AsO4,向滤液中加入MgSO4溶液,并滴加稀硫酸调节溶液pH=9左右,除去不溶物,得到含有MgSiO3、MgHPO4、MgHAsO4的滤渣Ⅱ,滤液主要是含Na2WO4的溶液,再加入稀硫酸调节pH=2并依次用R3N萃取除去水层后,再加入反萃取剂获得(NH4)2WO4的水溶液,经蒸发浓缩、冷却结晶、过滤洗涤(干燥)即可得到(NH4)2WO4晶体,最后将所得晶体焙烧即得到WO3,据此分析解题。
(1)钨酸盐(FeWO4、MnWO4)中Fe或Mn元素的化合价均为+2价,氧元素的化合价为-2价,设W元素化合价为x,则(+2)+(x)+(-2)×4=0,解得钨元素的化合价是+6价;“煅烧”过程中MnWO4和Na2CO3、O2在高温下反应生成Mn3O4,由质量守恒可知还有Na2WO4、CO2生成,发生反应的化学方程式是6MnWO4 + 6Na2CO3 + O2![]() 6Na2WO4 + 2Mn3O4 + 6CO2;
6Na2WO4 + 2Mn3O4 + 6CO2;
(2)溶浸时,为增大固体与水的接触面积,加快溶解速率,使固体充分溶解,提高原料的利用率,应将固体进行粉碎,并用玻璃棒不断搅拌;
(3)已知Ksp[Mg3(PO4)2]=c3(Mg2+)×c2(PO43-)=2.0×10-24、Ksp[Mg3(AsO4)2] =c3(Mg2+)×c2(AsO43-)=2.0×10-20,将溶液的pH调至9时,溶液中![]() =
=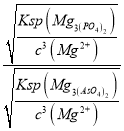 =
=![]() =10-2;
=10-2;
(4)加入反萃取剂的目的获得(NH4)2WO4溶液,即使3(R3NH)2SO4(油层)+ H2W12O406-(水层)![]() (R3NH)6H2W12O40(油层)+ 3SO42-(水层)平衡逆向移动,则应选择氨水或NH4HCO3溶液;不选择NaOH溶液,因其会引入杂质离子Na+;不选择NH4Cl溶液,因其会引入杂质离子Cl-,且不影响平衡的移动,故答案为AC;
(R3NH)6H2W12O40(油层)+ 3SO42-(水层)平衡逆向移动,则应选择氨水或NH4HCO3溶液;不选择NaOH溶液,因其会引入杂质离子Na+;不选择NH4Cl溶液,因其会引入杂质离子Cl-,且不影响平衡的移动,故答案为AC;
(5)操作A是指将(NH4)2WO4的水溶液经蒸发浓缩、冷却结晶、过滤洗涤(干燥)得到(NH4)2WO4晶体;(NH4)2WO4晶体焙烧生成WO3,同时得到NH3和水,发生反应的化学方程式是(NH4)2WO4![]() WO3+2NH3↑+H2O。
WO3+2NH3↑+H2O。

 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案