题目内容
【题目】下列关于元素周期表和元素周期律的说法正确的是()
A. 由于F元素的最低化合价为-1价,故F元素的最高化合价为+7价
B. 第二周期元素从Li到F,非金属性逐渐减弱
C. 由于K比Na容易失去电子,所以K比Na的还原性强
D. 由于H2S的相对分子质量大于H2O的相对分子质量,所以沸点前者大于后者
【答案】C
【解析】由于F元素的最低化合价为-1价, F元素没有正价,故A错误;第二周期元素从Li到F,非金属性逐渐增强,故B错误; K比Na的还原性强,故C正确; H2O分子间有氢键,水的沸点大于H2S,故D错误。

 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案【题目】对甲基苯胺可用对硝基甲苯在酸性条件下用铁粉还原制得:
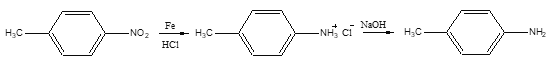
主要反应物和产物的物理性质见下表:
化合物 | 物质状态 | 溶解性 | 熔点(℃) | 沸点(℃) | 密度(g·cm-3) |
对硝基甲苯 | 浅黄色晶体 | 不溶于水,溶于乙醇、苯 | 51.4 | 237.7 | 1.286 |
对甲基苯胺 | 白色片状晶体 | 微溶于水,易溶于乙醇、苯 | 43~45 | 200~202 | 1.046 |
对甲基苯胺盐酸盐 | 白色晶体 | 易溶于水,不溶于乙醇、苯 | 243~245 | —— | —— |
苯 | 无色液体 | 不溶于水,溶于乙醇 | 5.5 | 80.1 | 0.874 |
实验流程如下:
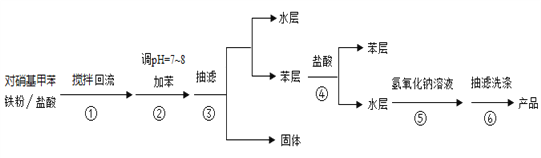
请回答下列问题:
(1)反应装置如图,a处缺少一装置_____________(填仪器名称)

(2)步骤②中加苯的作用是_____________,步骤②中用5%碳酸钠溶液调pH=7~8的原因_________
(3)步骤③得到的固体物质为_________
(4)步骤④中加入盐酸的作用是_____________
(5)步骤⑤中通过加入氢氧化钠溶液使对甲基苯胺结晶析出的原理为_____________
(6
A. 蒸馏水 B.乙醇 C.NaOH溶液 D.HCl溶液
【题目】I.某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定装置如图

(1)图中A的名称是:_____________________________
(2)若实验过程中酸碱添加过慢,所得△H将________(填:偏大、偏小或者无影响)
(3)取50mL NaOH溶液和30mL硫酸溶液进行实验,实验数据如表.
实验次数 | 起始温度t1/℃ | 终止温度 t2/℃ | ||
H2SO4 | NaOH | 平均值 | ||
1 | 26.2 | 26.0 | 26.1 | 30.1 |
2 | 27.0 | 27.4 | 27.2 | 33.3 |
3 | 25.9 | 25.9 | 25.9 | 29.8 |
4 | 26.4 | 26.2 | 26.3 | 30.4 |
近似认为0.50mol/L NaOH溶液和0.50mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g℃).则中和热△H=_____________(取小数点后一位).
II.为了研究硫酸铜的量对氢气生成速率的影响,某同学设计了如下一系列的实验:将表中所给的混合溶液分别加入到6个盛有过量Zn粒的容器中,收集产生的气体,记录获得相同体积的气体所需时间。
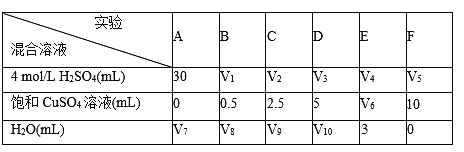
(4)请完成此实验设计,其中:V6=________,V8=___________
(5)该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高,请分析主要原因________________________。
III.利用间接酸碱滴定法可测定Ba2+的含量,实验分两步进行。
已知:2CrO42-+2H+=Cr2O72-+H2O Ba2++CrO42-=BaCrO4↓
步骤Ⅰ:移取xmL一定物质的量浓度的Na2CrO4溶液于锥形瓶中,加入酸碱指示剂
步骤Ⅱ:移取ymL BaCl2溶液于锥形瓶中,加入xmL与步骤Ⅰ相同浓度的Na2CrO4溶液,待Ba2+完全沉淀后,再加入酸碱指示剂,用bmol·L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V1mL。
(6)BaCl2溶液的浓度为___________mol·L-1,若步骤Ⅱ中滴加盐酸时有少量盐酸滴至锥形瓶外,Ba2+浓度测量值将______________(填“偏大”或“偏小”)。

