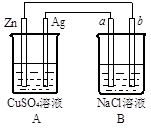题目内容
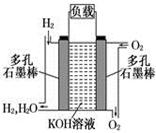
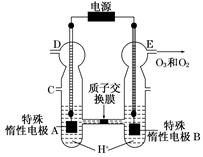
(12分)(1)右图为阳离子交换膜法电解饱和食盐水(滴有酚酞)原理示意图,E口产生H2,电解食盐水的离子方程式为: ,溶液变红色的是: 区(填A或B)。
(2)电化腐蚀是钢铁发生腐蚀的主要原因,又可分为吸氧腐蚀和析氢腐蚀,发生吸氧腐蚀的电极反应式:负极 正极
(3)下图是一套电化学实验装置,图中C、D均为铂电极,U为盐桥,G是灵敏电流计

此装置中进行的反应是可逆反应,其反应方程式式为:AsO43-+2I-+H+ AsO33-+I2+H2O,向B杯中加入适量较浓的硫酸,发现G的指针向右偏移。此时A杯中的主要实验现象是 D电极上的电极反应式为
AsO33-+I2+H2O,向B杯中加入适量较浓的硫酸,发现G的指针向右偏移。此时A杯中的主要实验现象是 D电极上的电极反应式为
⑴2Cl-+2H2O Cl2↑+H2↑+2OH-;溶液变红色的是 B区;
Cl2↑+H2↑+2OH-;溶液变红色的是 B区;
⑵吸氧腐蚀的电极反应式:负极 Fe- 2e-=Fe2+ 正极 O2+4e-+2H2O=4OH-
⑶实验现象是 溶液由无色变蓝色 电极反应式为 AsO43-+2e-+2H+=AsO33-+H2O
解析试题分析:(1)电解时在溶液中阳离子Na+、H+的放电能力H+ >Na+,所以在阴极发生反应:2H++2e-= H2↑,随着H+的不断放电,破坏了附近的水的电离平衡,最终使附近的水溶液显碱性,所以滴加酚酞溶液变为红色。即B区溶液变为红色;由于阴离子的沸点能力:Cl->OH-,在阳极Cl-放电产生氯气2Cl—2e-= Cl2↑,电解的总方程式为:2Cl-+2H2O Cl2↑+H2↑+2OH-。(2)钢铁发生吸氧腐蚀时Fe作负极,杂质C作正极。负极的电极反应式Fe- 2e-=Fe2+;正极的电极反应使是O2+4e-+2H2O=4OH-。(3)根据盐桥的示意图可知:在A杯中I-失去电子变为I2,I2遇淀粉变为蓝色。因此A烧杯的主要实验现象是溶液由无色变蓝色;在D电极上发生的电极反应为AsO43-+2e-+2H+=AsO33-+H2O。因此C为负极,D为正极。
Cl2↑+H2↑+2OH-。(2)钢铁发生吸氧腐蚀时Fe作负极,杂质C作正极。负极的电极反应式Fe- 2e-=Fe2+;正极的电极反应使是O2+4e-+2H2O=4OH-。(3)根据盐桥的示意图可知:在A杯中I-失去电子变为I2,I2遇淀粉变为蓝色。因此A烧杯的主要实验现象是溶液由无色变蓝色;在D电极上发生的电极反应为AsO43-+2e-+2H+=AsO33-+H2O。因此C为负极,D为正极。
考点:考查原电池、电解池的反应原理、电极反应、实验现象的等知识。

 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案以惰性电极电解一定浓度的CuSO4溶液,通电一段时间后,向所得的溶液中加入0.1mol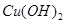 ,恰好恢复到电解前的pH和浓度,则电解过程中转移的电子的物质的量为:
,恰好恢复到电解前的pH和浓度,则电解过程中转移的电子的物质的量为:
| A.0.1mol | B.0.2mol | C.0.3mol | D.0.4mol |
(6分)ZnMnO2干电池应用广泛,其电解质溶液是ZnCl2NH4Cl混合溶液。
(1)该电池的负极材料是________。电池工作时,电子流向________(填“正极”或 负 )。
(2)若ZnCl2NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀,其主要原因是____________。
欲除去Cu2+,最好选用下列试剂中的________(填代号)。
| A.NaOH | B.Zn | C.Fe | D.NH3·H2O |