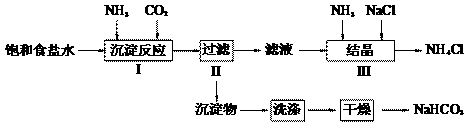
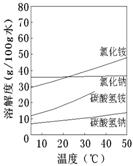
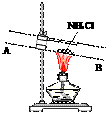
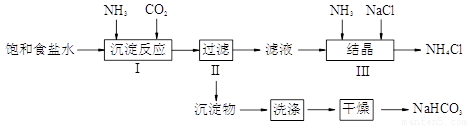
题目内容
在如下图所示的物质转化关系中,A是一种固体单质,E是一种白色不溶物,请完成下列问题:
(1)B的化学式为___________,目前B已被用作_____________________的主要原料。
(2)B和a溶液反应的离子方程式:____________________________________________。
(3)A和a溶液反应的离子方程式:_____________________________________________。
(4)C和过量盐酸反应的离子方程式:___________________________________________。
(1)SiO2 光导纤维
(2)SiO2+2OH-![]()
![]() +H2O
+H2O
(3)Si+2OH-+H2O![]()
![]() +2H2↑
+2H2↑
(4) ![]() +2H+
+2H+![]() H2SiO3↓
H2SiO3↓
解析:根据题给信息和框图,B是A的氧化物,能与同一种溶液反应的单质和其氧化物只有Si和SiO2,a溶液是强碱(如NaOH)溶液或HF溶液,而Si和SiO2与NaOH溶液反应均生成Na2SiO3。Na2SiO3与过量盐酸反应生成NaCl和H2SiO3白色沉淀:H2SiO3![]() SiO2+H2O,与题意相符。Si和SiO2与HF溶液反应均生成SiF4,SiF4与盐酸不反应。因此A是Si,B是SiO2,C是Na2SiO3(或K2SiO3),D是H2O,E是H2SiO3,F是H2,a是NaOH(或KOH)。
SiO2+H2O,与题意相符。Si和SiO2与HF溶液反应均生成SiF4,SiF4与盐酸不反应。因此A是Si,B是SiO2,C是Na2SiO3(或K2SiO3),D是H2O,E是H2SiO3,F是H2,a是NaOH(或KOH)。

能源问题是人类社会面临的重大课题,甲醇是未来重要的能源物质之一。
(1)合成甲醇的反应为:
CO(g)+2H2(g)![]() CH3OH(g);△H
CH3OH(g);△H
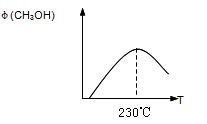
下图表示某次合成实验过程中甲醇的体积分数 φ(CH3OH)与反应温度的关系曲线,若在230℃时,平衡常数K=1。若其它条件不变,将温度升高到500℃时,达到平衡时,K 1 (填“>、< 或 = ”)
(2)利用甲醇燃料电池设计如下图所示的装置:则该装置中Cu极为 极;写出b极的电极反应式 ,当铜片的质量变化为12.8 g时:a极上消耗的O2在标准状况下的体积为 L。 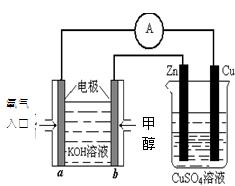
| 难(微)溶物 | 溶度积常数(Ksp) |
| BaSO4 | 1×10-10 |
| BaCO3 | 2.6×10-9 |
| CaSO4 | 7×10-5 |
| CaCO3 | 5×10-9 |
(3)工业中常将BaSO4转化为BaCO3后,再将其制成各种可溶性的钡盐(如:BaCl2)。
具体做法是用饱和纯碱溶液浸泡BaSO4粉末,并不断补充纯碱,最后BaSO4转化为BaCO3。现有足量BaSO4悬浊液,在该悬浊液中加纯碱粉末并不断搅拌,为使SO42-物质的量浓度达到0.0lmol·L-1以上,则溶液中CO32-物质的量浓度应≥ mol·L-1