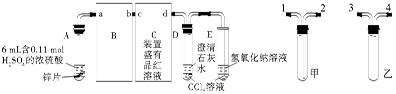题目内容
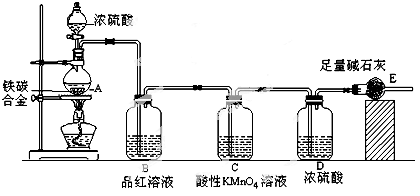
某化学学习小组设计如图实验装置(夹持装置略去)制备Cl2,并探究氯气的相关性质。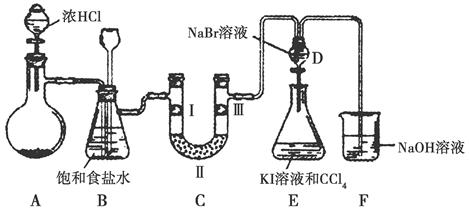
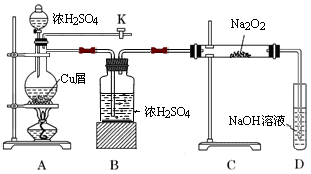
(1)若A装置中固体药品为KClO3,则反应中每生成1 mol Cl2时转移电子的物质的量为________mol。
(2)装置B既能除去氯气中的氯化氢,还能检测实验过程中装置C是否发生堵塞。若C中发生堵塞,B中将观察到的现象是________。
(3)装置C的作用是验证氯气是否具有漂白性,Ⅰ处是湿润的有色布条,则Ⅱ、Ⅲ处应加入的物质分别是____________________。
(4)设计装置D、E的目的是比较氯、溴、碘的非金属性。请简述能说明氯、溴、碘非金属性强弱的实验操作及现象:_______________。
(5)请用化学方程式说明装置F的作用:____________________。
(6)甲同学提出,装置F中的试剂可改用足量的Na2SO3溶液,乙同学认真思考后认为此法不可行。请用离子方程式解释乙认为不可行的原因:____________________________________。
(1)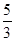
(2)B中长颈漏斗中液面上升,形成液柱
(3)无水氯化钙(硅胶、P2O5)、干燥的有色布条
(4)打开A中分液漏斗活塞,一段时间后,D中的无色溶液变为橙色(橙红色或黄色),说明氯的非金属性大于溴;打开D中活塞,将D中少量溶液放入装置E中,振荡,下层为紫红色,说明溴的非金属性大于碘
(5)Cl2+2NaOH=NaCl+NaClO+H2O
(6)SO32-+Cl2+H2O=SO42-+2Cl-+2H+、SO32-+2H+=SO2↑+H2O
解析

如图是某同学利用日常用品注射器设计简易实验装置。甲管中注入10mL CH4,同温、同压下乙管中注入50mL Cl2,将乙管气体推入甲管中,气体在甲管中反应,针管用日光照射一段时间。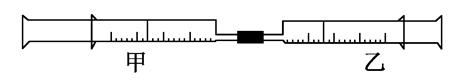
(1)下列是某同学预测的实验现象:
①气体最终变为无色;②实验过程中,甲管活塞向内移动;③甲管内壁有油珠;④产生火花。其中正确的是________。
(2)甲管中发生的化学反应类型为________。
(3)反应后,甲管中剩余气体能用下列试剂吸收的是_________
____________。
| A.水 | B.氢氧化钠溶液 |
| C.硝酸银溶液 | D.饱和食盐水 |
硫化氢(H2S)是一种具有臭鸡蛋气味的无色气体,有剧毒,存在于多种生产过程以及自然界中。在人体的很多生理过程中也起着重要作用。
资料:①H2S可溶于水?约1∶2?,其水溶液为二元弱酸。
②H2S可与许多金属离子反应生成沉淀。
③H2S在空气中燃烧,火焰呈淡蓝色。
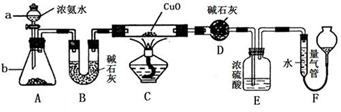
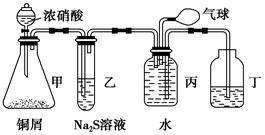
(1)某化学小组设计了制取H2S并验证其性质的实验,如下图所示。A中是CuSO4溶液,B中放有湿润的蓝色石蕊试纸,C中是FeCl3溶液。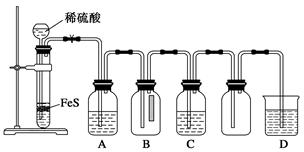
回答下列问题:
①A中有黑色沉淀(CuS)产生,A中发生反应的化学方程式为___________________。
②B中的现象是__________________。
③C中只有浅黄色沉淀产生,且溶液变浅绿色。则C中发生反应的离子方程式为______________。
④D中盛放的试剂可以是________(填字母序号)。
a.水 b.盐酸
c.NaCl溶液 d.NaOH溶液
(2)为进一步探究-2价硫的化合物与+4价硫的化合物反应条件,小明同学又设计了下列实验。
| | 实验操作 | 实验现象 |
| 实验1 | 将等浓度的Na2S和Na2SO3溶液按体积比2∶1混合 | 无明显现象 |
| 实验2 | 将H2S通入Na2SO3溶液中 | 未见明显沉淀,再加入少量稀硫酸,立即产生大量浅黄色沉淀 |
| 实验3 | 将SO2通入Na2S溶液中 | 有浅黄色沉淀产生 |
已知:电离平衡常数:
H2S Kal=1.3×10-7,Ka2=7.1×10-15
H2SO3 Ka1=1.7×10-2,Ka2=5.6×10-8
①根据上述实验,可以得出结论:在__________条件下,+4价硫化合物可以氧化-2价硫的化合物。
②将SO2气体通入H2S水溶液中直至过量,下列表示溶液pH随SO2气体体积变化关系示意图正确的是________(填字母序号)。
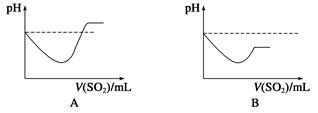

(3)文献记载,常温下H2S可与Ag发生置换反应生成H2。现将H2S气体通过装有银粉的玻璃管,请设计简单实验,通过检验反应产物证明H2S与Ag发生了置换反应______。