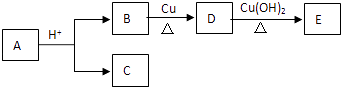
��Ŀ����
����Ŀ����ҵ����Ҫ����һ�����յĺ�ͭ�������쵨����CuSO45H2O�����÷����и��ֳɷݺ������£�Cu��CuOԼռ87%������ΪMg��Al��Fe��Si��������������������������ʣ���������Ϊ�� 
���ֽ���������������������ʽ��ȫ����ʱ��Һ��pH�����
������ | Al��OH��3 | Fe��OH��3 | Cu��OH��2 | Mg��OH��2 | Fe��OH��2 |
pH | 5.2 | 3.1 | 6.7 | 9.4 | 9.7 |
��ش��������⣺
��1���������ΪʲôҪ����ͭ������ĥ�ɷ�״�� ��
��2��������е����ӷ���ʽ��д��2�����ɣ����� ��
��3���������H2O2�μӷ�Ӧ�����ӷ���ʽ�� ��
��4��������е�����ҺpHʱ���˵�������������ţ���
A��NaOH B����ˮ C��Cu2��OH��2CO3 D��Cu��OH��2 E��MgCO3
��5������������������pH=2��3��ԭ���� ��
��6�������ķ��뷽�������� ��
���𰸡�
��1��������巴Ӧ��ı����������ѧ��Ӧ������
��2��2Al+2OH��+2H2O=2AlO2��+3H2����Si+2OH��+H2O=SiO32��+2H2����Al2O3+2OH��=2AlO2��+H2O��SiO2+2OH��=SiO32��+H2O
��3��2Fe2++H2O2+2H+=2Fe3++2H2O
��4��C��D
��5������Cu2+��ˮ�⣬Ҳ������������
��6������Ũ������ȴ�ᾧ�����ˣ���ϴ�ӡ����
���������⣺��ͭ�������쵨����CuSO45H2O����Cu��CuOԼռ87%������ΪMg��Al��Fe��Si��������������������������ʣ������ӹ����ȼ���Һ��Al��Si��������������Ӧ����������ˮ�����˵õ�����ΪCu��Mg��Fe��������������������������ʣ�ˮϴ��PH=7����ϡ���ᡢ˫��ˮ��80�汣��0.5h��CuO��MgO��FeO������ϡ������������ͭ������þ������������ͭ���������ӱ�˫��ˮ������ͭ���Ӻ����������ӣ�����PH=5.2������1Сʱ�����������ӳ�����ȫ�����˵õ�����������������Һ����Һ�к���ͭ���Ӻ�þ���ӣ������������ҺpH=2��3����������Һ����Ũ������ȴ�ᾧ�����˵õ���Ʒ������Ũ��ʱ�ᵼ��Cu2+����ˮ������Cu��OH��2 �� ���������pH=2��3��Ϊ������Cu2+��ˮ�⣬Ҳ�����������ʣ���1����Ӧ��ĽӴ�����뷴Ӧ���ʳ����ȣ�����ͭ������ĥ�ɷ�״��������巴Ӧ��ĽӴ�������ӿ��˷�Ӧ���ʣ����Դ��ǣ�������巴Ӧ��ı����������ѧ��Ӧ�����ʣ���2�������輰���������������趼����Ӧ����Ӧ�����ӷ���ʽΪ��2Al+2OH��+2H2O=2AlO2��+3H2���� Si+2OH��+H2O=SiO32��+2H2����Al2O3+2OH��=2AlO2��+H2O�� SiO2+2OH��=SiO32��+H2O�����Դ��ǣ�2Al+2OH��+2H2O=2AlO2��+3H2���� Si+2OH��+H2O=SiO32��+2H2����Al2O3+2OH��=2AlO2��+H2O��SiO2+2OH��=SiO32��+H2O����3�������������ǿ�����ԣ����������������Ϊ�����ӣ���������ԭΪˮ�����ӷ���ʽΪ��2Fe2++H2O2+2H+=2Fe3++2H2O�����Դ��ǣ�2Fe2++H2O2+2H+=2Fe3++2H2O����3������pH���������µ����ʣ�A������������ӣ�B�������笠����ӡ�E�������þ���ӣ�C��D�����ʻ�������ӷ�Ӧ����pH��ͬʱ����ͭ���ӣ����������µ����ʣ����Դ��ǣ�C��D����4��ͭ����Ϊ������������ˮ�⣬ˮ�ⷽ��ʽΪ��Cu2++2H2OCu��OH��2+2H+ �� ����ʱ��ٽ�ˮ�⣬�������ᣬ������H+����Ũ�ȣ�������ͭ����ˮ�⣬���Դ��ǣ�����Cu2+��ˮ�⣬Ҳ�����������ʣ���5�������Ϊ����Һ�л������ͭ���壬����Һ�еõ�����һ���ȡ����Ũ������ȴ�ᾧ�����ˣ���ϴ�ӡ���� �ķ��������Դ��ǣ�����Ũ������ȴ�ᾧ�����ˣ���ϴ�ӡ������