题目内容
如下图所示,A、E为石墨电极,B、F为铁片电极。按要求回答下列问题。
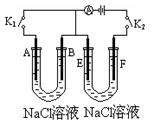
(1)打开K2,合并K1。B为 极,A的电极反应为 , 最终可观察到的现象是 ,
涉及的化学反应方程式有:
。
(2)打开K1,合并K2。
F为 极,F极的电极反应为 ,
电解过程中,观察到溶液的现象是 。

(1)打开K2,合并K1。B为 极,A的电极反应为 , 最终可观察到的现象是 ,
涉及的化学反应方程式有:
。
(2)打开K1,合并K2。
F为 极,F极的电极反应为 ,
电解过程中,观察到溶液的现象是 。
(1)负 O2 + 2H2O + 4e- = 4OH- 溶液中有红褐色沉淀生成2Fe+ O2 +2H2O =2Fe(OH)2 4Fe(OH)2 + O2 +2H2O= 4Fe(OH)3
(2)阳 Fe-2e-=Fe2+ 在U型管中间区域先出现白色沉淀,迅速出现灰绿色,最终出现红褐色。
(2)阳 Fe-2e-=Fe2+ 在U型管中间区域先出现白色沉淀,迅速出现灰绿色,最终出现红褐色。
(1)打开K2,合并K1,形成原电池,由于此溶液呈中性,故属于电化腐蚀中的吸氧腐蚀。
(2)打开K1,合并K2,形成电解池,由于铁作阳极,本身失电子,即Fe-2e-=Fe2+, 阴极电极反应式:2H+ +2e-=H2↑,破坏了水的电离平衡,使溶液呈碱性,会发生下列反应:Fe2++2OH-=Fe(OH)2↓,4Fe(OH)2 + O2 +2H2O= 4Fe(OH)3
(2)打开K1,合并K2,形成电解池,由于铁作阳极,本身失电子,即Fe-2e-=Fe2+, 阴极电极反应式:2H+ +2e-=H2↑,破坏了水的电离平衡,使溶液呈碱性,会发生下列反应:Fe2++2OH-=Fe(OH)2↓,4Fe(OH)2 + O2 +2H2O= 4Fe(OH)3

练习册系列答案
 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案
相关题目
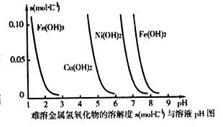
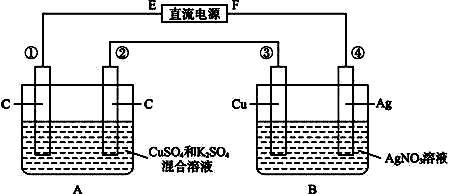
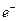 通过时(忽略电解时溶液体积的变化及电极产物可能存在的溶解现象),下列说法正确的是
通过时(忽略电解时溶液体积的变化及电极产物可能存在的溶解现象),下列说法正确的是