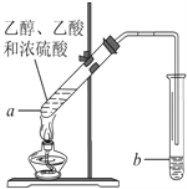
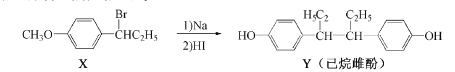
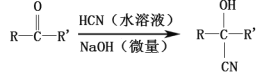
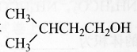题目内容
【题目】短周期元素X、Y、Z、M的原子序数依次增大,元素X的一种高硬度单质是宝石,Y2+电子层结构与氖相同,Z的质子数为偶数,室温下M单质为淡黄色固体,回答下列问题:
(1)M元素在周期表中的位置______________________________。
(2)Z元素在自然界中常见的二元化合物是_______,其与NaOH溶液反应的离子方程式为___________________________________________。
(3)X与M的单质能在高温下反应,生成产物的分子结构与CO2相似,请写出该产物分子的电子式_______________,其化学键属__________共价键(填“极性”或“非极性”)。
(4)四种元素中的____可用于航空航天合金材料的制备,其单质与X的一种氧化物反应的化学方程式为 _______________________________________。
【答案】 第三周期ⅥA族 SiO2 SiO2 +2OH- == SiO32- + H2O ![]() 极性 Mg 2Mg+ CO2 == 2MgO +C
极性 Mg 2Mg+ CO2 == 2MgO +C
【解析】短周期元素X、Y、Z、M的原子序数依次增大,元素X的一种高硬度单质是宝石,则X是C元素;Y2+电子层结构与氖相同,则Y是Mg元素;Z的质子数为偶数,室温下M单质为淡黄色固体,则Z是Si元素;M是S元素。
(1)M元素是S,核外电子排布是2、8、6,所以位于周期表中的第三周期第VIA族;(2)Z元素是Si元素,其在自然界中常见的二元化合物是SiO2,与氢氧化钠溶液反应的离子方程式为SiO2 +2OH- ==SiO32- + H2O;(3)X与M的单质在高温下反应产生CS2,结构与CO2类似,由于是不同元素的原子形成的共价键,所以其化学键属极性共价键,电子式为![]() ;(4)四种元素中只有Mg是金属元素,密度比较小,制成的合金硬度大,所以可用于航空航天合金材料的制备,该金属是比较活泼的金属,可以与二氧化碳反应生成氧化镁和碳,反应的化学方程式为2Mg+ CO2
;(4)四种元素中只有Mg是金属元素,密度比较小,制成的合金硬度大,所以可用于航空航天合金材料的制备,该金属是比较活泼的金属,可以与二氧化碳反应生成氧化镁和碳,反应的化学方程式为2Mg+ CO2 ![]() 2MgO +C。
2MgO +C。