题目内容
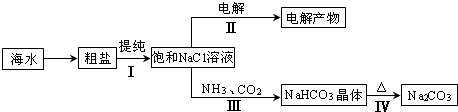
利用海水资源进行化工生产的部分工艺流程如下图所示: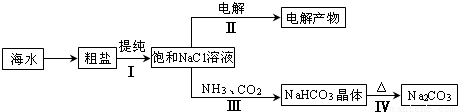
(1)流程Ⅰ中,欲除去粗盐中含有的Ca2+、Mg2+、SO42-等离子,需将粗盐溶解后,按序加入药品进行沉淀、过滤.其加入药品顺序合理的是______.
a.Na2CO3、NaOH、BaCl2溶液 b.NaOH、BaCl2、Na2CO3溶液
c.NaOH、Na2CO3、BaCl2溶液 d.BaCl2、Na2CO3、NaOH溶液
(2)流程Ⅱ中,电解饱和NaCl溶液的离子方程式为______ 2OH-+H2↑+Cl2↑
【答案】分析:(1)根据镁离子会与氢氧根离子和碳酸根离子生成沉淀,钙离子会与碳酸根离子生成沉淀,硫酸根离子会与钡离子生成沉淀,加入盐酸可以除去过量的碳酸钠和氢氧化钠等进行分析.
(2)依据电解原理分析判断产物书写离子方程式;阴极上是阳离子得到电子发生还原反应,氢离子和钠离子的离子结构和离子半径来分析得到电子的能力;
(3)流程Ⅲ是在饱和的氯化钠溶液中先通入氨气,再通入二氧化碳生成碳酸氢钠晶体和氯化铵;物质中碳酸氢钠的溶解度最小;
(4)①依据溶液中得到溶质晶体的方法是通过蒸发浓缩,冷却结晶,过滤洗涤;
②依据热化学方程式和盖斯定律计算得到;
解答:(1)过滤可以除去生成的沉淀和泥沙,加入过量的氢氧化钠可以除去镁离子,加入氯化钡可以除去硫酸根离子,加入适量的碳酸钠可以除去钙离子和反应剩余的氯化钡;加入适量的盐酸可以除去反应剩余的氢氧化钠和碳酸钠;
a、Na2CO3、NaOH、BaCl2溶液此顺序中钡离子不能除去,故a错误;
b、NaOH、BaCl2、Na2CO3溶液此顺序可以除去杂质离子,故b正确;
c、NaOH、Na2CO3、BaCl2溶液此顺序不能除去钡离子,故c错误;
d、BaCl2、Na2CO3、NaOH溶液次顺序可以除去杂质离子不引入新的杂质,故d正确;
故选bd;
(2)电解饱和NaCl溶液的离子方程式为:2Cl-+2H2O 2OH-+H2↑+Cl2↑;阴极之所以得到H2其原因是溶液中的阳离子移向阴极的有钠离子和氢离子,H+的半径比Na+的半径小,得电子的能力强所以氢离子先达到电子发生还原反应.
2OH-+H2↑+Cl2↑;阴极之所以得到H2其原因是溶液中的阳离子移向阴极的有钠离子和氢离子,H+的半径比Na+的半径小,得电子的能力强所以氢离子先达到电子发生还原反应.
故答案为:2Cl-+2H2O 2OH-+H2↑+Cl2↑;阳离子为Na+和H+,H+的半径比Na+的半径小,得电子的能力强;
2OH-+H2↑+Cl2↑;阳离子为Na+和H+,H+的半径比Na+的半径小,得电子的能力强;
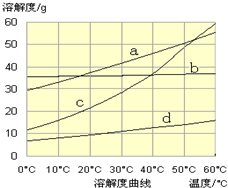
(3)依据反应原理可知,向饱和氯化钠溶液中先通入氨气,为了增大二氧化碳的反应量,利于碳酸氢钠晶体析出,反应的化学方程式为:NaCl+CO2 +NH3+H2O=NaHCO3↓+NH4Cl;NaCl、NH4Cl、NaHCO3、NH4HCO3 反应可知,碳酸氢钠在同温度下最小,曲线d为碳酸氢钠;
故答案为:d,NaCl+CO2 +NH3+H2O=NaHCO3↓+NH4Cl;
(4)①将碳酸钠样品加适量水溶解,通过蒸发浓缩,冷却结晶析出,过滤得到晶体;
故答案为:蒸发浓缩,冷却结晶;
②Na2CO3?H2O(s)=Na2CO3(s)+H2O(g)△H1=+58.73kJ?mol-1 (1)
Na2CO3?10H2O(s)=Na2CO3?H2O(s)+9H2O(g)△H1=+473.63kJ?mol-1 (2)
(1)+(2)得到Na2CO3?10H2O(s)=Na2CO3(s)+10H2O(g)△H3=+532.36kJ?mol-1
若不考虑能量无效损失,则理论上生产1molNa2CO3只需耗能92.36kJ;
所以水变化为液体时放热532.36KJ-92,36KJ=440KJ,10H2O(g)=10H2O(l)△H4=-440KJ/mol
H2O(g)=H2O(l)△H=-44.0KJ/mol;
故答案为:-44.0KJ/mol;
点评:本题考查了混合物分离的实验方法和试剂选择,工业制备纯碱的流程分析判断,盖斯定律计算应用,注意除杂的最后不能再有其他杂质,过滤要放在所有沉淀步骤的最后.题目难度中等.
(2)依据电解原理分析判断产物书写离子方程式;阴极上是阳离子得到电子发生还原反应,氢离子和钠离子的离子结构和离子半径来分析得到电子的能力;
(3)流程Ⅲ是在饱和的氯化钠溶液中先通入氨气,再通入二氧化碳生成碳酸氢钠晶体和氯化铵;物质中碳酸氢钠的溶解度最小;
(4)①依据溶液中得到溶质晶体的方法是通过蒸发浓缩,冷却结晶,过滤洗涤;
②依据热化学方程式和盖斯定律计算得到;
解答:(1)过滤可以除去生成的沉淀和泥沙,加入过量的氢氧化钠可以除去镁离子,加入氯化钡可以除去硫酸根离子,加入适量的碳酸钠可以除去钙离子和反应剩余的氯化钡;加入适量的盐酸可以除去反应剩余的氢氧化钠和碳酸钠;
a、Na2CO3、NaOH、BaCl2溶液此顺序中钡离子不能除去,故a错误;
b、NaOH、BaCl2、Na2CO3溶液此顺序可以除去杂质离子,故b正确;
c、NaOH、Na2CO3、BaCl2溶液此顺序不能除去钡离子,故c错误;
d、BaCl2、Na2CO3、NaOH溶液次顺序可以除去杂质离子不引入新的杂质,故d正确;
故选bd;
(2)电解饱和NaCl溶液的离子方程式为:2Cl-+2H2O
 2OH-+H2↑+Cl2↑;阴极之所以得到H2其原因是溶液中的阳离子移向阴极的有钠离子和氢离子,H+的半径比Na+的半径小,得电子的能力强所以氢离子先达到电子发生还原反应.
2OH-+H2↑+Cl2↑;阴极之所以得到H2其原因是溶液中的阳离子移向阴极的有钠离子和氢离子,H+的半径比Na+的半径小,得电子的能力强所以氢离子先达到电子发生还原反应.故答案为:2Cl-+2H2O
 2OH-+H2↑+Cl2↑;阳离子为Na+和H+,H+的半径比Na+的半径小,得电子的能力强;
2OH-+H2↑+Cl2↑;阳离子为Na+和H+,H+的半径比Na+的半径小,得电子的能力强;(3)依据反应原理可知,向饱和氯化钠溶液中先通入氨气,为了增大二氧化碳的反应量,利于碳酸氢钠晶体析出,反应的化学方程式为:NaCl+CO2 +NH3+H2O=NaHCO3↓+NH4Cl;NaCl、NH4Cl、NaHCO3、NH4HCO3 反应可知,碳酸氢钠在同温度下最小,曲线d为碳酸氢钠;
故答案为:d,NaCl+CO2 +NH3+H2O=NaHCO3↓+NH4Cl;
(4)①将碳酸钠样品加适量水溶解,通过蒸发浓缩,冷却结晶析出,过滤得到晶体;
故答案为:蒸发浓缩,冷却结晶;
②Na2CO3?H2O(s)=Na2CO3(s)+H2O(g)△H1=+58.73kJ?mol-1 (1)
Na2CO3?10H2O(s)=Na2CO3?H2O(s)+9H2O(g)△H1=+473.63kJ?mol-1 (2)
(1)+(2)得到Na2CO3?10H2O(s)=Na2CO3(s)+10H2O(g)△H3=+532.36kJ?mol-1
若不考虑能量无效损失,则理论上生产1molNa2CO3只需耗能92.36kJ;
所以水变化为液体时放热532.36KJ-92,36KJ=440KJ,10H2O(g)=10H2O(l)△H4=-440KJ/mol
H2O(g)=H2O(l)△H=-44.0KJ/mol;
故答案为:-44.0KJ/mol;
点评:本题考查了混合物分离的实验方法和试剂选择,工业制备纯碱的流程分析判断,盖斯定律计算应用,注意除杂的最后不能再有其他杂质,过滤要放在所有沉淀步骤的最后.题目难度中等.

练习册系列答案
相关题目