题目内容
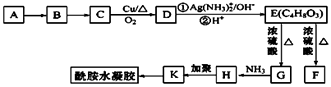
【题目】下图是某小组同学配制100 mL 0.100 mol·L-1Na2CO3溶液的一些关键步骤和操作图。
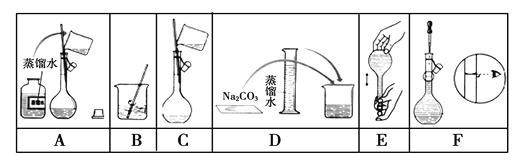
(1)配制过程所需的玻璃仪器有烧杯、玻璃棒、量筒、_________、___________。
(2)配制过程的先后顺序为(用字母A~F填写)________。
(3)步骤A通常称为洗涤,如果没有步骤A,则配得溶液的浓度将________(填“偏高”、“偏低”、“不变”);步骤F称为________,如果俯视刻度线,配得溶液的浓度将________(填“偏高”、“偏低”、“不变”)。
(4)用Na2CO3·10H2O来配制溶液,若晶体已经部分失去结晶水,则所配得溶液的浓度会________(填“偏高”、“偏低”、“不变”)。
(5)若配制NaOH 溶液,在步骤B之后,需________,才进行下一步操作。
【答案】 100 mL容量瓶 胶头滴管 DBCAFE 偏低 定容 偏高 偏高 冷却至室温
【解析】(1)从图中得到,配制的过程中使用的玻璃仪器有:100mL容量瓶、烧杯、玻璃棒、量筒、胶头滴管。所以答案为100mL容量瓶和胶头滴管。
(2)配制的过程是:将定量的碳酸钠固体溶解在烧杯里,将溶解液转移至容量瓶中,洗涤烧杯和玻璃棒两到三次,将每次的洗涤液也转移至容量瓶,加入蒸馏水至距离刻度线1~2cm处,改用胶头滴管滴加至凹液面与刻度线相切,最后倒转摇匀即可,所以顺序为:DBCAFE。
(3)如果不进行洗涤,在烧杯内壁和玻璃棒上的碳酸钠溶液就被损失了,所以浓度偏低。步骤F是定容,如果俯视刻度线,加入的水会偏少,所以配得溶液的浓度将偏高。
(4)用Na2CO3·10H2O来配制溶液,若晶体已经部分失去结晶水,则称量出的晶体中碳酸钠的质量将高于理论值(例如:假设需要106g碳酸钠,则应该称量286g的Na2CO3·10H2O,如果该Na2CO3·10H2O的结晶水都失去了,最后就得到了286g纯碳酸钠),所以所配得溶液的浓度会偏高。
(5)氢氧化钠溶于水会剧烈放热,使体系的温度升高,为了保证定容时体积的准确,应该先冷却至室温,再进行后续操作。