题目内容
【题目】高纯度氢氧化镁广泛应用于医药、电力等领域。镁硅酸盐矿石可用于生产氢氧化镁,简要工艺流程如图所示:

已知:①溶液I中除含Mg2+、SO42-外,还含少量Fe3+、Al3+、Fe2+等离子;
②Mg2+与氨水的反应为吸热反应。请回答下列问题:
(1)Mg在元素周期表中的位置为__________________。
(2)H2O2的电子式为________。溶液I中加入H2O2溶液发生反应的离子方程式是__________。
(3)向溶液I中首先加入的试剂是___________,产生沉淀的化学式为_________________。工业上有时只用一种含钠化合物替代H2O2和MgO,该试剂通常为___________(填化学式)。
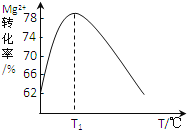
(4)溶液II中Mg2+转化率随温度T的变化情况如图所示:
①向溶液II中加入氨水发生反应的离子方程式是______________________。
②T1前Mg2+转化率增大的原因是_________________;
【答案】(1)第三周期IIA族(2分)
(2)![]() (2分);2Fe2++H2O2+2H+=2Fe3++2H2O(2分)
(2分);2Fe2++H2O2+2H+=2Fe3++2H2O(2分)
(3)H2O2(1分);Fe(OH)3、Al(OH)3(2分);Na2O2(或NaClO)(1分)
(4)①Mg2++2NH3·H2O![]() Mg(OH)2+2NH4+(2分,写成Mg2++2NH3·H2O=Mg(OH)2↓+2NH4+亦可)②镁离子与氨水的反应是吸热反应,温度升高,平衡正向移动(2分)
Mg(OH)2+2NH4+(2分,写成Mg2++2NH3·H2O=Mg(OH)2↓+2NH4+亦可)②镁离子与氨水的反应是吸热反应,温度升高,平衡正向移动(2分)
【解析】
试题分析:(1)镁是12号元素在周期表中的位置是第三周期ⅡA族。
(2)H2O2是共价化合物,电子式为![]() ;加入双氧水可以将亚铁离子氧化生成铁离子,反应的离子方程式为2Fe2+ + H2O2 +2H+ = 2Fe3+ + 2H2O。
;加入双氧水可以将亚铁离子氧化生成铁离子,反应的离子方程式为2Fe2+ + H2O2 +2H+ = 2Fe3+ + 2H2O。
(3)由于沉淀亚铁离子需要的pH较大,要先氧化再沉淀,所以向溶液中加入的两种试剂的先后顺序为H2O2、MgO,产生的沉淀是Fe(OH)3、Al(OH)3。工业上有时只用一种含钠化合物替代H2O2和MgO,该试剂通常为Na2O2(或NaClO)。
(4)①镁离子与氨水反应生成氢氧化镁和氢离子,方程式为:Mg2+ + 2NH3·H2O![]() Mg(OH)2↓ + 2NH4+。
Mg(OH)2↓ + 2NH4+。
②反应过程随着温度升高,镁离子的转化率增大,说明反应为吸热反应,温度升高,平衡正向移动。

 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案