题目内容
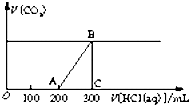 向200mL某物质的量浓度的NaOH溶液中缓慢通入一定量的CO2,充分反应,测得最后溶液的pH>7.
向200mL某物质的量浓度的NaOH溶液中缓慢通入一定量的CO2,充分反应,测得最后溶液的pH>7.(1)此时溶液的溶质如果是单一成分,可能是
Na2CO3或NaHCO3
Na2CO3或NaHCO3
;如果是多种成分,可能是NaOH和Na2CO3或Na2CO3和NaHCO3
NaOH和Na2CO3或Na2CO3和NaHCO3
.(2)在上述所得溶液中,逐滴缓慢滴加2mol?L-1的盐酸,所得气体(不考虑溶解于水)的体积与所加盐酸的体积关系如图所示:
①加入盐酸200mL之前,无气体产生,写出OA段发生反应的离子方程式
OH-+H+═H2O、CO32-+H+═HCO3-
OH-+H+═H2O、CO32-+H+═HCO3-
.②B点时,反应所得溶液中溶质的物质的量浓度是
1.2 mol?L-1
1.2 mol?L-1
(溶液体积的变化忽略不计).分析:(1)CO2与NaOH反应可生成Na2CO3或NaHCO3,二者溶液都呈碱性;
(2)加入盐酸200mL时开始生成气体,当加入盐酸300mL时不再产生气体,A→C段发生NaHCO3+HCl═NaCl+H2O+CO2↑,而O→A段消耗的盐酸为A→C的二倍,应为NaOH和Na2CO3的混合物,都可与盐酸反应,以此解答.
(2)加入盐酸200mL时开始生成气体,当加入盐酸300mL时不再产生气体,A→C段发生NaHCO3+HCl═NaCl+H2O+CO2↑,而O→A段消耗的盐酸为A→C的二倍,应为NaOH和Na2CO3的混合物,都可与盐酸反应,以此解答.
解答:解:(1)CO2与NaOH反应可生成Na2CO3或NaHCO3,二者溶液都呈碱性,则如果是单一成分,可能是Na2CO3或NaHCO3,如果是多种成分,若1<
<2,溶质是NaHCO3、Na2CO3.若
>2,溶质是Na2CO3、NaOH,
故答案为:Na2CO3或NaHCO3;NaOH和Na2CO3或Na2CO3和NaHCO3;
(2)①加入盐酸200mL时开始生成气体,当加入盐酸300mL时不再产生气体,A→C段发生NaHCO3+HCl═NaCl+H2O+CO2↑,而O-A段消耗的盐酸为A→C的二倍,应为NaOH和Na2CO3的混合物,都可与盐酸反应,反应的离子方程式分别为OH-+H+═H2O、CO32-+H+═HCO3-,
故答案为:OH-+H+═H2O、CO32-+H+═HCO3-;
②B点时,反应所得溶液中溶质为NaCl,由盐酸的物质的量可知为0.3L×2mol/L=0.6mol,则的物质的量浓度是
=1.2mol/L,
故答案为:1.2 mol?L-1.
| n(NaOH) |
| n(CO2) |
| n(NaOH) |
| n(CO2) |
故答案为:Na2CO3或NaHCO3;NaOH和Na2CO3或Na2CO3和NaHCO3;
(2)①加入盐酸200mL时开始生成气体,当加入盐酸300mL时不再产生气体,A→C段发生NaHCO3+HCl═NaCl+H2O+CO2↑,而O-A段消耗的盐酸为A→C的二倍,应为NaOH和Na2CO3的混合物,都可与盐酸反应,反应的离子方程式分别为OH-+H+═H2O、CO32-+H+═HCO3-,
故答案为:OH-+H+═H2O、CO32-+H+═HCO3-;
②B点时,反应所得溶液中溶质为NaCl,由盐酸的物质的量可知为0.3L×2mol/L=0.6mol,则的物质的量浓度是
| 0.6mol |
| 0.5L |
故答案为:1.2 mol?L-1.
点评:本题考查混合物的计算,题目难度中等,注意从图象分析反应可能的情况进行判断和计算,本题关键是根据图象判断溶液溶质的成分.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 (2012?信阳二模)如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视.为减小和消除CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究.
(2012?信阳二模)如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视.为减小和消除CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究.
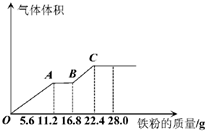 常温下,某200mL稀硫酸和稀硝酸的混合溶液最多能溶解19.2g铜粉(已知硝酸只被还原为NO气体),若再取等体积的该混合酸向其中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.下列有关分析错误的是( )
常温下,某200mL稀硫酸和稀硝酸的混合溶液最多能溶解19.2g铜粉(已知硝酸只被还原为NO气体),若再取等体积的该混合酸向其中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.下列有关分析错误的是( )


