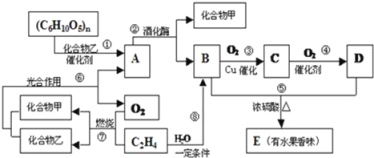
题目内容
【题目】人体血液存在H2CO3/HCO3—、HPO42-/H2PO4—等缓冲对。常温下,水溶液中各缓冲对的微粒浓度之比的对数值lg x[x表示![]() 或
或![]() ]与pH的关系如图所示。已知碳酸pKal═6.4、磷酸pKa2═7.2 (pKa═ -lgKa)。则下列说法不正确的是
]与pH的关系如图所示。已知碳酸pKal═6.4、磷酸pKa2═7.2 (pKa═ -lgKa)。则下列说法不正确的是

A. 曲线Ⅱ表示lg![]() 与pH的变化关系
与pH的变化关系
B. a~b的过程中,水的电离程度逐渐增大
C. 当c(H2CO3) ═c (HCO3—)时,c(HPO42—)=c(H2PO4—)
D. 当pH增大时,![]() 逐渐增大
逐渐增大
【答案】D
【解析】
由电离平衡H2CO3 ![]() HCO3-+H+、H2PO4-
HCO3-+H+、H2PO4- ![]() HPO42-+H+可知,随pH增大,溶液中c(OH-)增大,使电离平衡向右移动,H2CO3 /HCO3-减小,HPO42-/H2PO4-增大,所以曲线I表示lg[H2CO3 /HCO3-)]与pH的变化关系,曲线II表示lg[c(HPO42-)/c(H2PO4-)]与pH的变化关系,以此分析解答。
HPO42-+H+可知,随pH增大,溶液中c(OH-)增大,使电离平衡向右移动,H2CO3 /HCO3-减小,HPO42-/H2PO4-增大,所以曲线I表示lg[H2CO3 /HCO3-)]与pH的变化关系,曲线II表示lg[c(HPO42-)/c(H2PO4-)]与pH的变化关系,以此分析解答。
A. 根据以上分析,曲线I表示lg[H2CO3 /HCO3-)]与pH的变化关系,故A错误;
B. 曲线I表示lg[H2CO3 /HCO3-)]与pH的变化关系,a→b的过程中,c(HCO3-)逐渐增大,对水的电离促进作用增大,所以水的电离程度逐渐增大,故B错误;
C. 根据H2CO3 ![]() HCO3-+H+,Kal=
HCO3-+H+,Kal=![]() ;H2PO4-
;H2PO4- ![]() HPO42-+H+,Ka2=
HPO42-+H+,Ka2=![]() ;由题给信息可知,Ka1
;由题给信息可知,Ka1![]() Ka2,则当c(H2CO3) =c(HCO3— )时c(HPO42-)
Ka2,则当c(H2CO3) =c(HCO3— )时c(HPO42-)![]() c(H2PO4-),故C错误;
c(H2PO4-),故C错误;
D. 根据Kal=![]() ;Ka2=
;Ka2=![]() ,可得c(HCO3- )
,可得c(HCO3- )![]() c(H2PO4-)/c(HPO42-)=
c(H2PO4-)/c(HPO42-)=![]() c(H2CO3),
c(H2CO3),
当pH增大时,c(H2CO3)逐渐减小,所以c(HCO3- )![]() c(H2PO4-)/c(HPO42-)逐渐减小,故D正确。
c(H2PO4-)/c(HPO42-)逐渐减小,故D正确。
故答案选D。