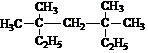题目内容
【题目】现向含6mol KI的硫酸溶液中逐滴加入KBrO3溶液,整个过程中含碘物质的物质的量与所加入KBrO3的物质的量的关系如图所示.
已知①BrO3﹣+6I﹣+6H+═3I2+Br﹣+3H2O;②2BrO3﹣+I2═2IO3﹣+Br2;
请回答下列问题:
(1)由反应②有同学由此得出氧化性:I2>Br2的结论,你认为是否正确(填是或否),并说明理由 .
(2)b点时,KI反应完全,则消耗的氧化剂与还原剂物质的量之比为 , 还原产物是 .
(3)b→c过程中只有一种元素的化合价发生变化,写出该过程的离子反应方程式 .
(4)含6mol KI的硫酸溶液所能消耗n(KBrO3)的最大值为 mol.
(5)n(KBrO3)=4时,对应含碘物质的化学式为 .
【答案】
(1)否;该反应中I2作还原剂,Br2为还原产物,应得出还原性I2>Br2结论
(2)1:6;KBr
(3)BrO3﹣+5Br﹣+6H+=3Br2+3H2O
(4)7.2
(5)I2 , KIO3
【解析】解:(1.)根据反应:2BrO3﹣+I2═2IO3﹣+Br2 , 还原剂的还原性强于还原产物的氧化性,所以得出还原性I2>Br2 , 所以答案是:否;该反应中I2作还原剂,Br2为还原产物,应得出还原性I2>Br2结论;
(2.)b点时,KI反应完全,有图象可知参加反应的KI为6mol,KBrO3为1mol,则消耗的氧化剂与还原剂物质的量之比为1:6,
发生反应为6I﹣+BrO3﹣=Br﹣+3I2 , 还原产物是KBr,所以答案是:1:6;KBr;
(3.)b→c过程中,仅有一种元素发生化合价变化,应是BrO3﹣与Br﹣之间的氧化还原反应,反应的离子方程式为BrO3﹣+5Br﹣+6H+=3Br2+3H2O,所以答案是:BrO3﹣+5Br﹣+6H+=3Br2+3H2O;
(4.)发生的反应依次有6I﹣+6H++BrO3﹣=Br﹣+3I2+3H2O,BrO3﹣+5Br﹣+6H+=3Br2+3H2O,2BrO3﹣+I2=2IO3﹣+Br2 , 总反应为5I﹣+6H++6BrO3﹣=5IO3﹣+3Br2+3H2O,则含6molKI的硫酸溶液所能消耗n(KBrO3)的最大值为1.2×6mol=7.2mol,所以答案是:7.2;
(5.)n(KBrO3)=4时,发生的反应依次有6I﹣+BrO3﹣=Br﹣+3I2 , BrO3﹣+5Br﹣+6H+=3Br2+3H2O,2BrO3﹣+I2=2IO3﹣+Br2 , 6molKI生成I2 , 需要1molKBrO3 , 同时生成1molKBr,发生BrO3﹣+5Br﹣+6H+=3Br2+3H2O,需要0.2molKBrO3 , 如I2完全被氧化生成KIO3 , 还应需要6molKBrO3 ,
则n(KBrO3)=4时,对应含碘物质的化学式为I2 , KIO3 ,
所以答案是:I2 , KIO3 .