题目内容
在硝酸生成过程中所排放出来的废气中含有NO和NO2, 它们污染环境。现在氨通过催化还原法将它们转化为无毒气体___________直接排入空气中。写出有关的反应方程式:______________。假设NO和NO2物质的量之比恰好为1:1,则两者的混合物相当于一种酸酐。写出由烧碱溶液吸收这种酸酐的化学方程式_____________。
N2;6NO2 +8NH3 7N2 +12H2O;6NO + 4NH3
7N2 +12H2O;6NO + 4NH3 5N2 +6H2O;
5N2 +6H2O;
NO +NO2 + 2NaOH= 2NaNO2 +H2O
 7N2 +12H2O;6NO + 4NH3
7N2 +12H2O;6NO + 4NH3 5N2 +6H2O;
5N2 +6H2O;NO +NO2 + 2NaOH= 2NaNO2 +H2O
试题分析:氮的氧化物和氨气之间发生的反应是氮元素之间的氧化还原反应,所以生成的无毒气体是氮气,反应的化学方程式分别是6NO2 +8NH3
 7N2 +12H2O,6NO + 4NH3
7N2 +12H2O,6NO + 4NH3 5N2 +6H2O。如果NO和NO2物质的量之比恰好为1:1,则氮元素的平均化合价是
5N2 +6H2O。如果NO和NO2物质的量之比恰好为1:1,则氮元素的平均化合价是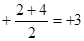 价,所以对应的酸酐是N2O3,相应的钠盐是NaNO3,因此反应的化学方程式是NO+NO2+2NaOH= 2NaNO2+H2O。
价,所以对应的酸酐是N2O3,相应的钠盐是NaNO3,因此反应的化学方程式是NO+NO2+2NaOH= 2NaNO2+H2O。点评:该题的关键是抓住“无毒的气体”,然后根据元素的化合价,即可以准确判断出其产物是氮气,也就是说该反应是氮元素之间发生的氧化还原反应,生成物的价态只能位于中间价态。该题难度不大。

练习册系列答案
相关题目