题目内容
【题目】2013年初,雾霾天气多次肆虐我国中东部地区。其中,汽车尾气和燃煤尾气是造成空气污染的原因之一。
汽车尾气净化的主要原理为:2NO(g)+2CO(g)![]() 2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示。
2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示。
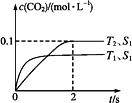
据此判断:
(1)该反应的ΔH____(填“>”或“<”)0。
(2)在T2温度下,0~2 s内的平均反应速率v(N2)=____。
(3)当固体催化剂的质量一定时,增大其表面积可提高化学反应速率。若催化剂的表面积S1>S2,在上图中画出c(CO2)在T1、S2条件下达到平衡过程中的变化曲线。___________________
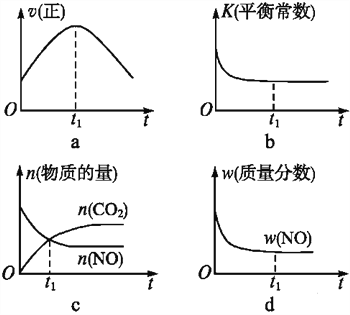
(4)若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是____(填代号)。
【答案】 < 0.025 mol·L-1·s-1 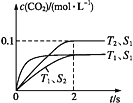 bd
bd
【解析】考查化学反应速率的计算、勒夏特列原理,(1)先拐先平衡说明反应速率快,即T1>T2,根据图像温度低,CO2浓度大,说明正反应是放热反应,即△H<0;(2)根据化学反应速率的数学表达式,v(CO2)=0.1/2mol/(L·s)=0.05mol/(L·s),根据化学反应速率之比等于化学计量数之比,因此v(N2)=v(CO2)/2=0.025mol/(L·s);(3)表面积越大,化学反应速率越快,但对化学平衡移动无影响,因此图像是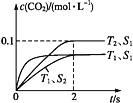 ;(4)a、随着反应的进行,v(正)减小,故a错误;b、平衡常数不变,说明温度不变,反应达到平衡,故b正确;c、根据图像,t1时,没有达到平衡,故c错误;d、当质量分数不变,说明反应达到平衡,故d正确。
;(4)a、随着反应的进行,v(正)减小,故a错误;b、平衡常数不变,说明温度不变,反应达到平衡,故b正确;c、根据图像,t1时,没有达到平衡,故c错误;d、当质量分数不变,说明反应达到平衡,故d正确。

练习册系列答案
 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案
相关题目