题目内容
1.下列有关说法不正确的是( )| A. | 纤维素、油脂、蛋白质均为高分子化合物 | |
| B. | 35%~40%的甲醛水溶液称为福尔马林,具有杀菌、防腐性能 | |
| C. | 淀粉、溴乙烷、脂肪在一定条件下都可以发生水解反应 | |
| D. | 脂肪烃的来源有石油、天然气和煤等,通过石油的裂化及裂解可得到气态烯烃 |
分析 A.油脂的相对分子质量在10000以下;
B.甲醛能使蛋白质发生变性;
C.淀粉水解生成葡萄糖,溴乙烷水解生成乙醇、脂肪水解生成高级脂肪酸(或盐)和甘油;
D.石油、天然气聚含烃类物质,煤干馏产品中含烃类物质,石油裂化的目的是为了提高轻质液体燃料(汽油,煤油,柴油等)的产量,特别是提高汽油的产量,裂解的目的是为了获得乙烯、丙烯、丁二烯、丁烯、乙炔等.
解答 解:A.高分子的相对分子质量在10000以上,纤维素、蛋白质均为高分子化合物,而油脂不是,故A错误;
B.甲醛能使蛋白质发生变性,35%~40%的甲醛水溶液称为福尔马林,具有杀菌、防腐性能,故B正确;
C.淀粉水解生成葡萄糖,溴乙烷水解生成乙醇、脂肪水解生成高级脂肪酸(或盐)和甘油,则淀粉、溴乙烷、脂肪在一定条件下都可以发生水解反应,故C正确;
D.石油、天然气聚含烃类物质,煤干馏产品中含烃类物质,则脂肪烃的来源有石油、天然气和煤等,通过石油的裂化及裂解可得到气态烯烃,故D正确;
故选A.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系、化石能源的综合应用为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
11.下列各反应的化学方程式或离子方程式中,属于水解反应的是( )
| A. | H2O+H2O?H3O++OH- | B. | HCO3-+OH-?H2O+CO32- | ||
| C. | CO2+H2O?H2CO3 | D. | CO32-+H2O?HCO3-+OH- |
12.下列有关金属腐蚀与防护的说法正确的是( )
| A. | 金属腐蚀包括化学腐蚀和电化学腐蚀两种,其中化学腐蚀更为普遍 | |
| B. | 在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法 | |
| C. | 当镀锡铁制品的镀层破损时,镀层仍能对铁制品起保护作用 | |
| D. | 可将地下输油钢管与外加直接电源的正极相连以保护它不受腐蚀 |
16.下列装置及操作均正确的是( )
| A. | 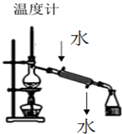 装置用于分离两种沸点相差较大的液体互溶混合物 | |
| B. |  装置称量氢氧化钠固体 | |
| C. |  装置配制一定物质的量浓度的稀硫酸 | |
| D. |  装置检查容量瓶是否漏水 |
6.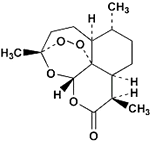 2015年10月5日,中国科学家屠呦呦首次获诺贝尔生理学或医学奖,以表彰她发现了一种药物--青蒿素,它是由菊科植物在低湿条件下提炼出来的一种化合物,是治疗疟疾的特效药,其结构简式如图所示.下列有关青蒿素的说法不正确的是( )
2015年10月5日,中国科学家屠呦呦首次获诺贝尔生理学或医学奖,以表彰她发现了一种药物--青蒿素,它是由菊科植物在低湿条件下提炼出来的一种化合物,是治疗疟疾的特效药,其结构简式如图所示.下列有关青蒿素的说法不正确的是( )
 2015年10月5日,中国科学家屠呦呦首次获诺贝尔生理学或医学奖,以表彰她发现了一种药物--青蒿素,它是由菊科植物在低湿条件下提炼出来的一种化合物,是治疗疟疾的特效药,其结构简式如图所示.下列有关青蒿素的说法不正确的是( )
2015年10月5日,中国科学家屠呦呦首次获诺贝尔生理学或医学奖,以表彰她发现了一种药物--青蒿素,它是由菊科植物在低湿条件下提炼出来的一种化合物,是治疗疟疾的特效药,其结构简式如图所示.下列有关青蒿素的说法不正确的是( )| A. | 青蒿素的分子式为C15H22O5 | |
| B. | 青蒿素不易溶于水,可溶于乙醚 | |
| C. | 青蒿素在一定条件下可发生水解、取代、加成、氧化反应 | |
| D. | 青蒿素分子内的一个过氧基团是对付疟原虫的核心基团 |
11.镍是有机合成的重要催化剂.某化工厂有含镍催化剂废品(主要成分是镍,杂质是铁、铝单质及其化合物,少量难溶性杂质).某学习小组设计如图流程利用含镍催化剂废品制备硫酸镍晶体:
几种难溶碱开始沉淀和完全沉淀的pH:
回答下列问题:
(1)溶液①中含有金属的离子是AlO2-.
(2)用离子方程式表示加入双氧水的目的2Fe2++H2O2+2H+=2Fe3++2H2O.
(3)操作b调节溶液范围为3.2~7.1,其目的是除去Fe3+,固体②的化学式为Fe(OH)3.
(4)操作a和c需要共同的玻璃仪器是玻璃棒.上述流程中,防止浓缩结晶过程中Ni2+水解的措施是硫酸过量.
(5)如果加入双氧水量不足或“保温时间较短”,对实验结果的影响是产品中混有绿矾.设计实验证明产品中是否含“杂质”:取少量样品溶于蒸馏水,滴加酸性高锰酸钾溶液,若溶液紫色褪去,则产品中含有亚铁离子.(不考虑硫酸镍影响)
(6)取2.000g硫酸镍晶体样品溶于蒸馏水,用0.2000mol•L-1的EDTA(Na2H2Y)标准溶液滴定至终点,消耗EDTA标准溶液为34.50mL.反应为Ni2++H2Y2?=NiY2?+2H.计算样品纯度为97.0%.(已知,NiSO4•7H2O相对分子质量为281,不考虑杂质反应).

几种难溶碱开始沉淀和完全沉淀的pH:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| 开始沉淀 | 3.8 | 2.7 | 7.6 | 7.1 |
| 完全沉淀 | 5.2 | 3.2 | 9.7 | 9.2 |
(1)溶液①中含有金属的离子是AlO2-.
(2)用离子方程式表示加入双氧水的目的2Fe2++H2O2+2H+=2Fe3++2H2O.
(3)操作b调节溶液范围为3.2~7.1,其目的是除去Fe3+,固体②的化学式为Fe(OH)3.
(4)操作a和c需要共同的玻璃仪器是玻璃棒.上述流程中,防止浓缩结晶过程中Ni2+水解的措施是硫酸过量.
(5)如果加入双氧水量不足或“保温时间较短”,对实验结果的影响是产品中混有绿矾.设计实验证明产品中是否含“杂质”:取少量样品溶于蒸馏水,滴加酸性高锰酸钾溶液,若溶液紫色褪去,则产品中含有亚铁离子.(不考虑硫酸镍影响)
(6)取2.000g硫酸镍晶体样品溶于蒸馏水,用0.2000mol•L-1的EDTA(Na2H2Y)标准溶液滴定至终点,消耗EDTA标准溶液为34.50mL.反应为Ni2++H2Y2?=NiY2?+2H.计算样品纯度为97.0%.(已知,NiSO4•7H2O相对分子质量为281,不考虑杂质反应).
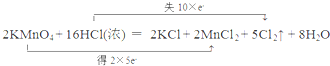 .
.