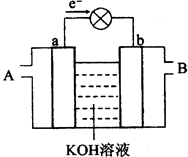
题目内容
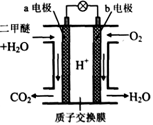
以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,其工作原理如图所示。下列说法正确的是
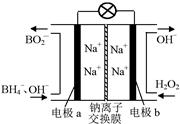

| A.电池放电时Na+从b极区移向a极区 |
| B.每消耗3 mol H2O2,转移的电子为3 mol |
| C.电极a采用MnO2,MnO2既作电极材料又有催化作用 |
| D.该电池的负极反应为:BH4-+8OH--8e-=BO2-+6H2O |
D
试题分析:A、读图可知,氧元素由—1价降为—2价,发生还原反应,则b为电池的正极,氢由—1价升为+1价,发生氧化反应,则a为电池负极,阳离子从负极区移向正极区,故Na+从a极区移向b极区,错误;B、根据电子、电荷、原子守恒可知,正极反应式为H2O2+2e—=2OH—,故每消耗1.5molH2O2,转移3mol电子,错误;C、若MnO2作催化剂,双氧水应该分解为氧气和水,故MnO2无催化作用,错误;D、根据电子、电荷、原子守恒可知,负极反应式为BH4-+8OH--8e-=BO2-+6H2O,正确。

练习册系列答案
 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案
相关题目
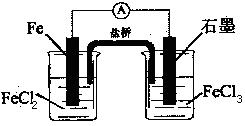
 2Fe3+
2Fe3+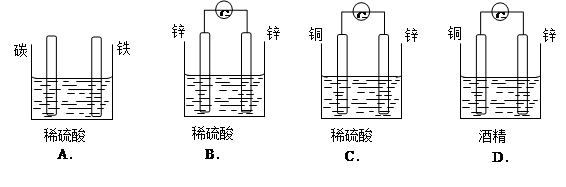
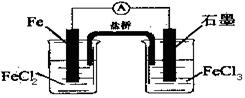
 2Fe3+
2Fe3+