题目内容
某研究性学习小组为确定某纯净碱式碳酸镁样品的组成,设计出了下图所示的实验装置(图中A至D的部分)。[已知碱式碳酸镁Mgx(OH)y(CO3)z(x、y、z为正整数)加热能分解生成氧化镁、水和二氧化碳]
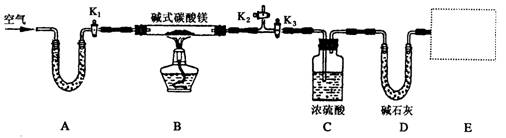
(1)按上图(夹持仪器未画出)组装好实验装置后,应首先进行的操作是__________;A处U形管盛放的药品是__________________,其作用为_______________________。
(2)指导老师在审阅设计方案后指出需要在E处增加一装置,你认为该装置应该是_____________________________.
(3)加热前需要向该装置缓缓鼓入空气数分钟,其目的是___________________;此时对活塞的操作方法是:打开活塞____________________,关闭活塞_________________。
(4)关闭活塞K1、K2,打开K3,加热一段时间后,同学们发现C处洗气瓶中几乎没有气泡冒出,这是由于_________________________。
(5)反应完全后,打开K1,再缓缓鼓入空气数分钟,其目的是_____________________。
(6)实验测得数据如下:碱式碳酸镁样品22.6 g;反应前C装置的质量为87.6 g,反应后质量为89.4 g;反应前D装置的质量为74.7 g,反应后质量为83.5 g。请计算推导该碱式碳酸镁的化学式______________________,该碱式碳酸镁受热分解的化学方程式为____________。

(1)按上图(夹持仪器未画出)组装好实验装置后,应首先进行的操作是__________;A处U形管盛放的药品是__________________,其作用为_______________________。
(2)指导老师在审阅设计方案后指出需要在E处增加一装置,你认为该装置应该是_____________________________.
(3)加热前需要向该装置缓缓鼓入空气数分钟,其目的是___________________;此时对活塞的操作方法是:打开活塞____________________,关闭活塞_________________。
(4)关闭活塞K1、K2,打开K3,加热一段时间后,同学们发现C处洗气瓶中几乎没有气泡冒出,这是由于_________________________。
(5)反应完全后,打开K1,再缓缓鼓入空气数分钟,其目的是_____________________。
(6)实验测得数据如下:碱式碳酸镁样品22.6 g;反应前C装置的质量为87.6 g,反应后质量为89.4 g;反应前D装置的质量为74.7 g,反应后质量为83.5 g。请计算推导该碱式碳酸镁的化学式______________________,该碱式碳酸镁受热分解的化学方程式为____________。
(共15分)
(1)检查装置的气密性; 碱石灰(或氧化钙); 除去进入装置的空气中所含带的水蒸气和二氧化碳。(3分,每空1分)
(2)盛有碱石灰(或氧化钙)的干燥管。(2分)
(3)赶走装置中含有水蒸气和二氧化碳的空气;(2分)K1、K2(1分);K3(1分)。
(4) B装置中的反应已完全。(1分)
(5)将反应生成的残留在装置中的水蒸气和二氧化碳全部赶到装置C和D中。(1分)
(6) Mg3(OH)2(CO3)2[或 Mg(OH)2·2MgCO3],
Mg3(OH)2(CO3)2 3MgO + 2CO2↑+H2O (4分,每空2分)
3MgO + 2CO2↑+H2O (4分,每空2分)
(1)检查装置的气密性; 碱石灰(或氧化钙); 除去进入装置的空气中所含带的水蒸气和二氧化碳。(3分,每空1分)
(2)盛有碱石灰(或氧化钙)的干燥管。(2分)
(3)赶走装置中含有水蒸气和二氧化碳的空气;(2分)K1、K2(1分);K3(1分)。
(4) B装置中的反应已完全。(1分)
(5)将反应生成的残留在装置中的水蒸气和二氧化碳全部赶到装置C和D中。(1分)
(6) Mg3(OH)2(CO3)2[或 Mg(OH)2·2MgCO3],
Mg3(OH)2(CO3)2
 3MgO + 2CO2↑+H2O (4分,每空2分)
3MgO + 2CO2↑+H2O (4分,每空2分)略

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目







 +IBr →
+IBr → ②IBr+KI=I2+KBr ③I2+2S2O32-=2I-+S4O62-
②IBr+KI=I2+KBr ③I2+2S2O32-=2I-+S4O62-