题目内容
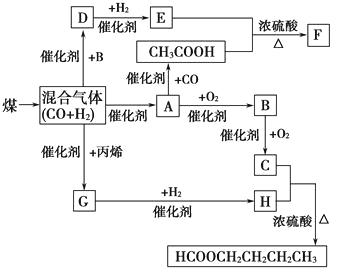
【题目】现有一种以黄铜矿和硫磺为原料制取铜和其他产物的新工艺,原料的综合利用率较高.其主要流程如图: 
注:反应Ⅱ的离子方程式为Cu2++CuS+4Cl﹣=2[CuCl2]﹣+S↓
请回答下列问题:
(1)反应Ⅲ中的CuCl2﹣中铜元素的化合价为 , 传统工艺制铜是将铜矿砂与空气在高温下煅烧,使这种方
法的缺点是要消耗大量的热能以及(完成合理的一种即可).
(2)为使反应Ⅰ中充分进行,工业可采取的措施是 , 反应Ⅰ生成12gFeS2转移的电子数为 .
(3)反应Ⅲ的离子方程式为 , 一定温度下,在反应Ⅲ所得的溶液中加入稀硫酸,可以析出硫酸铜晶
体,其可能的原因是 .
(4)工业上炼钢时,可将铁红投入熔融的生铁中,炼钢时为了降低含碳量,该过程中主要反应的化学方程
式是 . 工业上可以用NaOH溶液或氨水吸收过量的SO2 , 分别生成NaHSO3、NH4HSO3 , 其水溶液均
呈酸性,相同条件下,同浓度的两种水溶液中c(SO32﹣)较小的是 .
(5)某硫酸厂为测定反应Ⅳ所得气体中SO2的体积分数,取280mL(已折算成标准状况)气体样品与足量
Fe2(SO4)3溶液完全反应后,用浓度为0.02000molL﹣1的K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液25.00mL,已知Cr2O72﹣+Fe2++H+→Cr3++Fe3++H2O(未配平)反应Ⅳ所得气体中SO2的体积分数为 .
【答案】
(1)0;SO2会导致大气污染
(2)粉碎固体等;0.1NA
(3)4CuCl2﹣+O2+4H+═4Cu2++8Cl﹣+2H2O;该温度下,硫酸铜的溶解度小于氯化铜
(4)3C+Fe2O3 ![]() 2Fe+3CO;NH4HSO3溶液
2Fe+3CO;NH4HSO3溶液
(5)12.00%
【解析】解:流程中反应Ⅰ的化学化方程为CuFeS2+S═FeS2+CuS,黄铜矿与S在高温下煅烧,使其转变为FeS2、CuS,加入HCl、NaCl、CuCl2混合溶液 发生反应Cu2++CuS+4Cl﹣=2[CuCl2]﹣+S↓,过滤得到滤液中通入空气发生反应4CuCl2﹣+O2+4H+=4Cu2++8Cl﹣+2H2O,一定温度下,在反应Ⅲ所得的溶液中加入稀硫酸,可以析出硫酸铜晶体,结晶分离得到硫酸铜晶体,加入铁还原溶液得到铜;滤渣分离得到FeS和S,(1)反应Ⅲ中的CuCl2﹣中Cl是﹣1价,铜元素的化合价为0价,富铜矿砂与空气在高温下煅烧,要消耗大量的热能,生成SO2会导致大气污染,所以答案是:0;SO2会导致大气污染;(2)粉碎固体可以增大接触面积,加快反应速率,则为使反应Ⅰ充分进行,工业上可采取的措施是粉碎固体等,流程中反应Ⅰ的化学化方程为CuFeS2+S═FeS2+CuS,反应Ⅰ生成120gFeS2转移的电子1mol,所以反应Ⅰ生成12gFeS2转移的电子数为0.1NA ,
所以答案是:粉碎固体等;0.1NA;(3)反应Ⅲ中生成铜离子,则离子反应为4CuCl2﹣+O2+4H+═4Cu2++8Cl﹣+2H2O,相同条件下硫酸铜的溶解度小,则该温度下,硫酸铜的溶解度小于氯化铜,所以向反应Ⅲ所得的溶液中加入稀硫酸,可以析出硫酸铜晶体,
所以答案是:4CuCl2﹣+O2+4H+═4Cu2++8Cl﹣+2H2O;该温度下,硫酸铜的溶解度小于氯化铜;(4)炼钢时,可将铁红投入熔融的生铁中,滤液碳和氧化铁反应生成铁和一氧化碳,反应的化学方程式为:3C+Fe2O3 ![]() 2Fe+3CO↑,HSO3﹣H++SO32﹣ , 而NH4+水解:NH4++H2ONH3 . H2O+H+ , 使溶液中c(H+)增大,抑制HSO3﹣电离,故NH4HSO3溶液中SO32﹣浓度较小,
2Fe+3CO↑,HSO3﹣H++SO32﹣ , 而NH4+水解:NH4++H2ONH3 . H2O+H+ , 使溶液中c(H+)增大,抑制HSO3﹣电离,故NH4HSO3溶液中SO32﹣浓度较小,
所以答案是:3C+Fe2O3 ![]() 2Fe+3CO↑;NH4HSO3;(5)发生氧化还原反应生成硫酸亚铁,离子反应为SO2+2Fe3++2H2O=SO42﹣+2Fe2++4H+ , 利用14H++Cr2O72﹣+6Fe2+═2Cr3++6Fe3++7H2O、SO2+2Fe3++2H2O=SO42﹣+2Fe2++4H+ ,
2Fe+3CO↑;NH4HSO3;(5)发生氧化还原反应生成硫酸亚铁,离子反应为SO2+2Fe3++2H2O=SO42﹣+2Fe2++4H+ , 利用14H++Cr2O72﹣+6Fe2+═2Cr3++6Fe3++7H2O、SO2+2Fe3++2H2O=SO42﹣+2Fe2++4H+ ,
可知,3SO2~Cr2O72﹣ ,
3 1
x 0.02mol/L×0.025L
解得x=0.0015mol,
反应Ⅳ所得气体中SO2的体积分数为: ![]() ×100%=12.00%,
×100%=12.00%,
所以答案是:12.00%.