题目内容
已知25℃时,Ka(HF)=3.6×10-4,Ksp(CaF2)=1.46×10-10。现向1 L 0.2 mol·L-1 HF溶液
中加入1 L 0.2 mol·L-1 CaCl2溶液,则下列说法中,正确的是 ( )
A.25℃时,0.1 mol·L-1 HF溶液中pH=1 B.Ksp(CaF2)随温度和浓度的变化而变化
C.该体系中没有沉淀产生 D.该体系中HF与CaCl2反应产生沉淀
【答案】
D
【解析】
试题分析:现向lL0.2
mol·L-1HF溶液中加入1L0.2 mol·L-1CaCl2溶液,则此时c(F-)×c(H+)/c(HF)=3.6×10-4,所以c(F-)=c(H+)=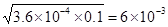 mol/L。由于c(Ca2+)=0.1mol·L-1,则此时c(F-)×c(F-)×c(Ca2+)=3.6×10-6>1.46×10-10,所以必然会析出CaF2,D正确,A和C不正确。溶度积常数和浓度没有关系,只与温度有关系,B不正确,答案选D。
mol/L。由于c(Ca2+)=0.1mol·L-1,则此时c(F-)×c(F-)×c(Ca2+)=3.6×10-6>1.46×10-10,所以必然会析出CaF2,D正确,A和C不正确。溶度积常数和浓度没有关系,只与温度有关系,B不正确,答案选D。
考点:考查溶度积常数、电离常数的有关计算和判断
点评:该题是中等难度的试题,也是高考中的常见考点和题型。试题贴近高考,综合性强,有利于培养学生的严谨的逻辑思维能力和发散思维能力,有助于培养学生的应试能力,提高学生的学习效率和学习积极性。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目