题目内容
铝元素在自然界中主要存在于铝土矿(主要成分为Al2O3,还含有Fe2O3、FeO、SiO2)中。工业上用铝土矿制备铝的某种化合物的工艺流程如下。

(1)在滤液A中加入漂白液,目的是氧化除铁,所得滤液B显酸性。
①检验滤液B中是否还含有铁元素的方法为: (注明试剂、现象)。
②检验滤液A中是否含有Fe2+的试剂是 ,其实验现象为 。
③由滤液B制备氯化铝晶体涉及的操作为:边滴加浓盐酸边蒸发浓缩、冷却结晶、 (填操作名称)、洗涤。
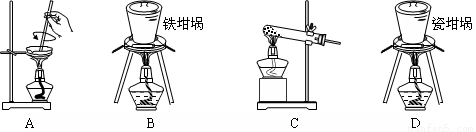
(2)SiO2和NaOH焙烧制备硅酸钠,可采用的装置为 (填代号)。
(1)①取少量滤液B,加入KSCN溶液,若不变红,再加入氯水,仍然不变红,说明滤液B中不含铁元素。(其他合理答案均得分)
②酸性KMnO4 滴入的酸性KMnO4的紫红色褪去(其他合理答案均得分)
③过滤
(2)B
【解析】
试题解析:(1)①滤液B中铁元素的存在形式为Fe3+和Fe2+,所以检验是否还有铁元素也即检验是否还有Fe3+和Fe2+,因此取少量滤液B,加入KSCN溶液,若不变红,再加入氯水,仍然不变红,说明滤液B中不含铁元素。
②滤液A中含有Fe3+和Fe2+,检验Fe2+的存在需选择和Fe2+反应而不和Fe3+反应的试剂且现象明显,例如,酸性KMnO4溶液,溴水等。
③滴加浓盐酸目的是在加热过程中防止氯化铝水解,冷却结晶后得氯化铝的晶体,过滤可得。
(2)蒸发皿、玻璃试管、瓷坩埚中均含有SiO2,易与NaOH反应,所以制备硅酸钠应选择铁坩埚,答案选B。
考点:考查铝、硅化合物在工业生产中的应用以及铁元素的检验

练习册系列答案
相关题目