题目内容
(10分)(1)可逆反应N2(g)+3H2(g) 2NH3(g)是一个放热反应,有甲乙两个完全相同的容器,向甲容器中加入1molN2和3molH2在一定条件下,达到平衡时放出的热量为Q1,相同条件下,向乙容器中加入2molNH3,达到平衡时,吸收的热量为Q2,已知Q2=4Q1,则甲容器中H2的转化率为 。
2NH3(g)是一个放热反应,有甲乙两个完全相同的容器,向甲容器中加入1molN2和3molH2在一定条件下,达到平衡时放出的热量为Q1,相同条件下,向乙容器中加入2molNH3,达到平衡时,吸收的热量为Q2,已知Q2=4Q1,则甲容器中H2的转化率为 。
(2)除电解法,工业炼镁还可采用硅热法(Pidgeon法)。即以煅白(CaO·MgO)为原料与硅铁(含硅75%的硅铁合金)混合置于密闭还原炉,1200℃下发生反应:
(CaO·MgO)(s) + Si(s) Ca2SiO4 (l) + 2Mg(g)
Ca2SiO4 (l) + 2Mg(g)
①已知还原性:Mg > Si,上述反应仍能发生的原因是______________________________
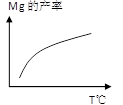
②由右图,推测上述反应正向为______(填“吸热”或“放热”)反应;平衡后若其他条件不变,将还原炉体积缩小一半,则达到新平衡时Mg(g)的浓度将______(填“升高” 、“降低”或“不变”)。
③若还原炉容积为400m3,原料中煅白质量为9.6 t,5小时后,测得煅白的转化率为50%,
计算这段时间Mg的生成速率 ___________ 。
 2NH3(g)是一个放热反应,有甲乙两个完全相同的容器,向甲容器中加入1molN2和3molH2在一定条件下,达到平衡时放出的热量为Q1,相同条件下,向乙容器中加入2molNH3,达到平衡时,吸收的热量为Q2,已知Q2=4Q1,则甲容器中H2的转化率为 。
2NH3(g)是一个放热反应,有甲乙两个完全相同的容器,向甲容器中加入1molN2和3molH2在一定条件下,达到平衡时放出的热量为Q1,相同条件下,向乙容器中加入2molNH3,达到平衡时,吸收的热量为Q2,已知Q2=4Q1,则甲容器中H2的转化率为 。 (2)除电解法,工业炼镁还可采用硅热法(Pidgeon法)。即以煅白(CaO·MgO)为原料与硅铁(含硅75%的硅铁合金)混合置于密闭还原炉,1200℃下发生反应:
(CaO·MgO)(s) + Si(s)
 Ca2SiO4 (l) + 2Mg(g)
Ca2SiO4 (l) + 2Mg(g) ①已知还原性:Mg > Si,上述反应仍能发生的原因是______________________________
②由右图,推测上述反应正向为______(填“吸热”或“放热”)反应;平衡后若其他条件不变,将还原炉体积缩小一半,则达到新平衡时Mg(g)的浓度将______(填“升高” 、“降低”或“不变”)。

③若还原炉容积为400m3,原料中煅白质量为9.6 t,5小时后,测得煅白的转化率为50%,
计算这段时间Mg的生成速率 ___________ 。
(1)20℅(2分)
(2)①1200℃时反应生成的镁以蒸气的形式逸出,使平衡向正反应方向移动,故能发生(2分);
② 吸热(2分);不变(∵K= [Mg]2,∴温度不变,K值不变);(2分)
④0.025 mol/(L·h) [或25 mol/(m3·h),2分,单位不写扣1分]
(2)①1200℃时反应生成的镁以蒸气的形式逸出,使平衡向正反应方向移动,故能发生(2分);
② 吸热(2分);不变(∵K= [Mg]2,∴温度不变,K值不变);(2分)
④0.025 mol/(L·h) [或25 mol/(m3·h),2分,单位不写扣1分]
试题分析:(1)已知Q2=4Q1,容器甲乙中发生的反应是等效的,故Q2+Q1=Q,即5Q1=Q,因此甲容器中H2的转化率为w = Q1/Q=20℅;
(2)①1200℃时反应生成的镁以蒸气的形式逸出,使平衡向正反应方向移动,故能发生;②随着温度的升高,产率逐渐增大,故反应正向为吸热;K= [Mg]2,温度不变,K值不变,故达到新平衡时Mg(g)的浓度不变;
④2(CaO·MgO)(s) + Si(s)
 Ca2SiO4 (l) + 2Mg(g)
Ca2SiO4 (l) + 2Mg(g) 192 48
9.6t×50% m
m = 1.2t,n = (1.2×106g)/ 24g/mol = 50000mol
这段时间Mg的生成速率v = 50000mol÷(400×103)L ÷ 5h =" 0.025" mol/(L·h)
点评:本题综合考查学生对可逆反应的化学平衡的掌握,涉及化学方程式的计算,计算较为简单,总体难度不大。

练习册系列答案
相关题目
 2SO3(g)
2SO3(g) B(g)+C(g)。若反应物的浓度由3 mol·L-1降到1.8 mol·L-1需30 s,那么反应物浓度由0.8 mol·L-1降至0.2 mol·L-1所需反应时间为( )
B(g)+C(g)。若反应物的浓度由3 mol·L-1降到1.8 mol·L-1需30 s,那么反应物浓度由0.8 mol·L-1降至0.2 mol·L-1所需反应时间为( )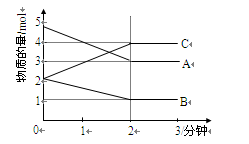
 2NH3,在5 min内,N2的物质的量浓度由6 mol / L,变为2 mol / L,则用NH3表示该反应在这段时间的平均速率为
2NH3,在5 min内,N2的物质的量浓度由6 mol / L,变为2 mol / L,则用NH3表示该反应在这段时间的平均速率为  2C(g)+D(g),经2 min,B的浓度减少0.6 mol/L,对此反应速率的表示不正确的是( )
2C(g)+D(g),经2 min,B的浓度减少0.6 mol/L,对此反应速率的表示不正确的是( )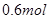 气体X和
气体X和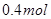 气体Y混合于2L容器中,发生反应:
气体Y混合于2L容器中,发生反应: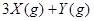
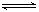
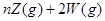 ,5分钟末已生成
,5分钟末已生成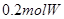 ,若测知以Z浓度变化来表示的平均速率为
,若测知以Z浓度变化来表示的平均速率为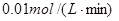 ,则:
,则: