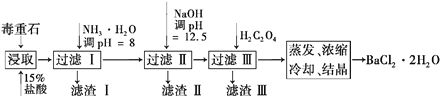
题目内容
【题目】CO和H2可作为能源和化工原料,应用十分广泛。
(1)已知:C(s)+O2(g)===CO2(g)ΔH1=-393.5 kJ·mol-1
2H2(g)+O2(g)===2H2O(g)ΔH2=-483.6 kJ·mol-1
C(s)+H2O(g)===CO(g)+H2(g)ΔH3=131.3 kJ·mol-1
则反应CO(g)+H2(g)+O2(g)===H2O(g)+CO2(g)的ΔH=________kJ·mol-1。标准状况下的煤气(CO、H2)44.8 L与氧气反应生成CO2和H2O,反应过程中转移________mol电子。
(2)密闭容器中充有10 mol CO与20 mol H2,在催化剂作用下反应生成甲醇:
CO(g)+2H2(g)![]() CH3OH(g);CO的平衡转化率(α)与温度、压强的关系如图所示。
CH3OH(g);CO的平衡转化率(α)与温度、压强的关系如图所示。
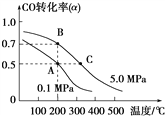
①若A、B两点表示在某时刻达到的平衡状态,此时在B点时容器的体积为6 L,则该温度下的平衡常数K=________;此时在A点时容器的体积VA_______6 L(填“大于”“小于”或“等于”)。该反应为________(填“放热反应”或“吸热反应”)。
②若A、C两点都表示达到的平衡状态,则自反应开始到达平衡状态所需的时间tA________tC(填“大于”“小于”或“等于”)。
【答案】 -524.8 4 ![]() 大于 放热 大于
大于 放热 大于
【解析】(1)已知:①C(s)+O2(g)===CO2(g)ΔH1=-393.5 kJ·mol-1
②2H2(g)+O2(g)===2H2O(g)ΔH2=-483.6 kJ·mol-1
③C(s)+H2O(g)===CO(g)+H2(g)ΔH3=131.3 kJ·mol-1
利用盖斯定律,将①-③可得反应CO(g)+H2(g)+O2(g)═H2O(g)+CO2(g) △H=-393.5kJ·mol-1-131.3kJ·mol-1=-524.8kJ·mol-1;CO、H2与氧气反应的方程式分别为:2CO+O2 ![]() 2CO2;2H2+O2
2CO2;2H2+O2 ![]() 2H2O,从方程式可以看出相同物质的量的CO、H2燃烧转移的电子数目相等,标准状况下CO、H244.8L与氧气反应生成CO2和H2O转移的电子的物质的量为=
2H2O,从方程式可以看出相同物质的量的CO、H2燃烧转移的电子数目相等,标准状况下CO、H244.8L与氧气反应生成CO2和H2O转移的电子的物质的量为=![]() =4mol;(2))①根据图象可以看出,B点时CO的转化率为70%此时在B点时容器的体积为6 L,则平衡时各物质的量浓度为:c(CO)=3mol/6L=0.5mol·L-1;c(H2)=6mol/6L=1mol·L-1;c(CH3OH)=7mol/6L=7/6mol·L-1;所以平衡常数为
=4mol;(2))①根据图象可以看出,B点时CO的转化率为70%此时在B点时容器的体积为6 L,则平衡时各物质的量浓度为:c(CO)=3mol/6L=0.5mol·L-1;c(H2)=6mol/6L=1mol·L-1;c(CH3OH)=7mol/6L=7/6mol·L-1;所以平衡常数为![]() =7/3; 从B点转变为A点,CO的转化率减小,平衡向逆向移动,应减小压强,所以在A点时容器的体积大于6L。由图升高温度,CO的转化率减小,平衡逆向移动,正反应为放热反应;②升高温度,反应速率增大,反应开始到达平衡状态所需的时间要少,所以反应开始到达平衡状态所需的时间tA大于tC。
=7/3; 从B点转变为A点,CO的转化率减小,平衡向逆向移动,应减小压强,所以在A点时容器的体积大于6L。由图升高温度,CO的转化率减小,平衡逆向移动,正反应为放热反应;②升高温度,反应速率增大,反应开始到达平衡状态所需的时间要少,所以反应开始到达平衡状态所需的时间tA大于tC。

 阅读快车系列答案
阅读快车系列答案