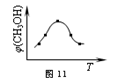
题目内容
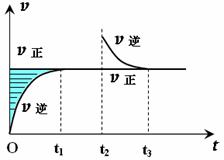 某恒温密闭容器发生可逆反应Z(?)+W(?)
某恒温密闭容器发生可逆反应Z(?)+W(?)![]() X(g)+Y(?) ΔH ,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后未再改变条件。下列有关说法中不正确的是 ( )
X(g)+Y(?) ΔH ,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后未再改变条件。下列有关说法中不正确的是 ( )
A.Z和W在该条件下一定不为气态
B.t1~t2时间段与t3时刻后,两时间段反应体系中气体的平均
摩尔质量不可能相等
(※是命题者原创题,难度较大,本选项由于命题者未考 虑周全作了修改,否则无答案。)
C.若在该温度下此反应平衡常数表达式为K=c(X),则t1~t2
时间段与t3时刻后的X浓度相等
D.若该反应只在某温度T0以上自发进行,则该反应的平衡常数K随温度升高而增大
【答案】B
【解析】由于v (正)在增大压强后未发生变化,说明选项A正确。若 Y是气体且n(X):n(Y)=1:1,则改变条件前后气体的摩尔质量不变,若Y是气体且n(X):n(Y)≠1:1,则改变条件前后气体的摩尔质量将发生改变,B错。选项C中由于是特殊反应,根据平衡常数的定义可知是正确的。由于该反应是熵增的反应,而选项中又强调该反应只在某温度T0以上才能自发进行,说明该反应是吸热反应,由此可知选项D正确。
【考点】化学反应速率与化学平衡——平衡常数的应用

氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答下列问题:
(1)常温下,某氨水的pH=12,则水电离的c(OH-)= 。若向该氨水中加入等体积、等物质的量浓度的盐酸,此时溶液中水电离的程度 (填“大于”、“等于”或“小于”)氨水中水的电离程度。
(2)合成氨反应N2(g)+3H2(g) 2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,则平衡
移动(填“向左”、“向右”或“不”)。
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,则平衡
移动(填“向左”、“向右”或“不”)。
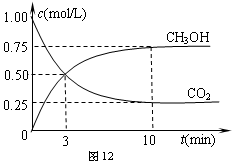
(3)一定温度下,在密闭容器中可发生下列反应:2N2O5(g)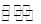 4NO2(g)+O2(g)。下表为反应在T1温度下的部分实验数据:
4NO2(g)+O2(g)。下表为反应在T1温度下的部分实验数据:
|
T/s |
0 |
500 |
1000 |
|
c(N2O5)/mol·L-1 |
⑤.00 |
3.50 |
2.42 |
则500s内N2O5的分解速度v(N2O5)=
;降温至T2,反应进行1000s时测得c(NO2)=4.98mol·L-1,则反应N2O5(g)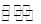 NO2(g)+O2(g)的△H 0。(填“>”、“=”、“<”)。
NO2(g)+O2(g)的△H 0。(填“>”、“=”、“<”)。
(4)最近美国Simons等科学家发明了使NH3直接用于燃料电池的方法,其装置用铂黑作电极、加入电解质溶液中,一个电极通入空气,另一电极通入NH3。其电池反应式为:
4NH3+3O2
2N2+6H2O。你认为电解质溶液应显 (填“酸性”、“中性”或“碱性”),写出正极的电极反应方程式
。
 新型纳米材料氧缺位铁酸盐(ZnFe2Ox),由该铁酸盐(ZnFe2O4)经高温还原制得,常温下,它能使工业废气中酸性氧化物分解除去,转化流程如图所示:
新型纳米材料氧缺位铁酸盐(ZnFe2Ox),由该铁酸盐(ZnFe2O4)经高温还原制得,常温下,它能使工业废气中酸性氧化物分解除去,转化流程如图所示: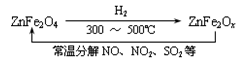
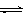 CH3OH(g)+H2O(g) △H3
CH3OH(g)+H2O(g) △H3