题目内容
在密闭容器中,进行如下反应:2A(g)+2B(g)  C(g)+2D(g);ΔH<0,达到平衡后,为提高该反应的速率并使平衡向正反应方向移动,采取的正确措施是( )
C(g)+2D(g);ΔH<0,达到平衡后,为提高该反应的速率并使平衡向正反应方向移动,采取的正确措施是( )
| A.加催化剂同时升高温度 | B.加催化剂同时增大压强 |
| C.升高温度同时充入A气体 | D.降低温度同时增大压强 |
B
解析

练习册系列答案
 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案
相关题目
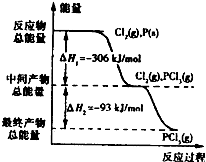 如图是红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)的反应过程和能量关系图.其中PCl5(g)分解成PCl3(g)和Cl2(g)的反应是一个可逆反应,温度T℃时,在密闭容器中加入0.6mol PCl5,达平衡时,PCl5还剩0.45mol,其分解率为α,则下列推断不正确的是( )
如图是红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)的反应过程和能量关系图.其中PCl5(g)分解成PCl3(g)和Cl2(g)的反应是一个可逆反应,温度T℃时,在密闭容器中加入0.6mol PCl5,达平衡时,PCl5还剩0.45mol,其分解率为α,则下列推断不正确的是( )| A、α等于25% | B、若升高温度,平衡时PCl5的分解率小于α | C、若初始时加入0.6mol PCl3和0.6 mol Cl2,以相同条件进行反应,则平衡时PCl3转化率为3α | D、PCl5分解的热化学方程式为:PCl5(g)?PCl3(g)+Cl2(g)△H=-93kJ?mol-1 |
反应CO(g)+2H2(g)?2CH3OH(g)在密闭容器中进行.为探究温度、CO2等对该反应的影响,进行了4组实验,结果如图.下列说法不正确的是( )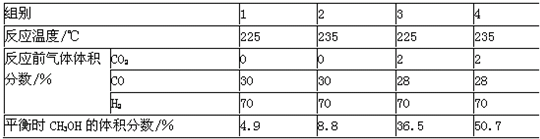

| A、该反应的△H>0 | B、当容器中压强不变时,反应达到平衡 | C、CH3OH含量增大的原因是CO2起了催化作用 | D、少量CO2能提高平衡时CH3OH的体积分数 |
 qC(g)在密闭容器中进行.如图所示反应在不同时间t,温度T和压强P与反应物B的体积分数的关系曲线.根据图象填空((1)、(2)、(3)题填“>”、“<”或“=”):
qC(g)在密闭容器中进行.如图所示反应在不同时间t,温度T和压强P与反应物B的体积分数的关系曲线.根据图象填空((1)、(2)、(3)题填“>”、“<”或“=”):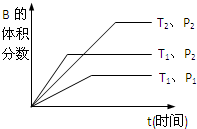
 (2012?石家庄一模)常温下,A为无色无味液体,B为淡黄色粉末,D、E、G、W为气体,且G的相对分子质量比D大16,各物质间的转化关系如图所示:
(2012?石家庄一模)常温下,A为无色无味液体,B为淡黄色粉末,D、E、G、W为气体,且G的相对分子质量比D大16,各物质间的转化关系如图所示: 已知某可逆反应mA(g)+nB(g)?pC(g),在密闭容器中进行,如图表示在不同反应时间t、温度T和压强P与反应物B在混合气体中的百分含量B%的关系曲线,由曲线分析,下列判断正确的是( )
已知某可逆反应mA(g)+nB(g)?pC(g),在密闭容器中进行,如图表示在不同反应时间t、温度T和压强P与反应物B在混合气体中的百分含量B%的关系曲线,由曲线分析,下列判断正确的是( )