题目内容
4.已知:A为淡黄色固体,E、X常温下为无色无味的气体,A、B、C、D含有相同的金属离子,其转化关系如图(部分产物已略去)请问答下列问题:
(1)B中所含化学键的类型是离子键、共价键.
(2)①C也可转化为B,写出该转化的化学方程式Na2CO3+Ca(OH)2=CaCO3↓+2NaOH;②B与D反应的离子方程式为HCO3-+OH-=CO32-+H2O.
(3)将一定量的气体X通人2LB的溶液中,向所得溶液中一边逐滴加人稀盐酸一边振荡至过量,产生的气体与盐酸物质的量的关系如图(忽略气体的溶解和HCl的挥发).则a点溶液中所含溶质的化学式为Na2CO3和NaCl,b点溶液中各离子浓度由大到小的关系是c(Na+)>c(Cl-)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-).
(4)将C溶液与氢氧化钡溶液混合可得不溶物F.F的Ksp=2.5×10-.现将该不溶物放入0.5mol•L的BaCl溶液中,其不变(填“增大”、“减小”或“不变”),组成不溶物F的阴离子在溶液中的浓度为5×10-9mol•L.
分析 E、X常温下为无色无味气体,A为含金属离子的淡黄色固体化合物,能与水反应生成E与B,应是过氧化钠与水反应生成氢氧化钠与氧气,则A为Na2O2,E为O2,B为NaOH,B与X可以连续反应,可推知X为CO2,C为Na2CO3,D为NaHCO3,据此解答.
解答 解:E、X常温下为无色无味气体,A为含金属离子的淡黄色固体化合物,能与水反应生成E与B,应是过氧化钠与水反应生成氢氧化钠与氧气,则A为Na2O2,E为O2,B为NaOH,B与X可以连续反应,可推知X为CO2,C为Na2CO3,D为NaHCO3,
(l)B为NaOH,含有离子键、共价键,
故答案为:离子键、共价键;
(2)①碳酸钠也可转化为氢氧化钠,该转化的化学方程式为:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH,
故答案为:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH;
②B为NaOH,D为NaHCO3,B与D反应的离子方程式为HCO3-+OH-=CO32-+H2O,
故答案为:HCO3-+OH-=CO32-+H2O;
(3)根据Na2CO3+HCl=NaHCO3+NaCl、NaHCO3+HCl=NaCl+H2O+CO2↑知,Na2CO3转化为NaHCO3、NaHCO3转化为NaCl需要的HCl的物质的量相等,实际上产生气体之前消耗盐酸与产生二氧化碳消耗盐酸体积之比=3:2,所以溶液中还存在NaOH,说明原溶液中为NaOH、Na2CO3,结合方程式可知,溶液中n(NaOH):n(Na2CO3)=1:2,故a点是氢氧化钠恰好与盐酸反应碳酸钠未反应,a点时溶液中的溶质是Na2CO3和NaCl,b点时,碳酸钠恰好转化为碳酸氢钠,b点溶液中的溶质是NaHCO3和NaCl,且n(NaHCO3):n(NaCl)=2:3,钠离子和氯离子不水解,根据元素守恒知c(Na+)>c(Cl-)>c(HCO3-),NaHCO3为强碱弱酸酸式盐,其溶液呈碱性,则c(OH-)>c(H+),碳酸氢根离子水解程度大于电离程度,碳酸氢根离子电离生成碳酸根离子,水和碳酸氢根离子都电离生成氢离子,所以c(H+)>c(CO32-),
故答案为:Na2CO3和NaCl;c(Na+)>c(Cl-)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-);
(4)F是BaCO3,温度不变,溶度积常数不变,溶液中c(Ba2+)≈0.5mol/L,则溶液中c(CO32-)=$\frac{2.5×10{\;}^{-9}}{0.5}$mol/L=5×10-9mol/L,
故答案为:不变;5×10-9.
点评 本题考查了无机物推断,涉及化学键、热化学方程式、离子浓度大小比较、溶度积有关计算等知识点,(3)为易错点,清楚发生的反应判断原溶液中溶质及物质的量关系是关键,题目难度中等.

| A. | v(N2)=0.25mol•L-1•min-1 | B. | v(H2)=0.0125 mol•L-1•s-1 | ||
| C. | v(NH3)=1.0 mol•L-1•min-1 | D. | v(H2)=0.75 mol•L-1•min-1 |
| A. | 碘是人体必需微量元素,所以要多吃富含高碘酸的食物 | |
| B. | 易燃试剂与强氧化性试剂分开放置并远离火源 | |
| C. | 浓H2SO4溅到皮肤上,立即用碳酸钠稀溶液洗涤 | |
| D. | 氢氧化钠浓溶液溅入眼中,应立即用大量水冲洗,再用稀盐酸冲洗 |
| A. | 标准状况下,2.24L CCl4 含有的分子数为0.1NA | |
| B. | 500mL lmol•L-1的K2SO4溶液中K+的物质的量为2mol | |
| C. | 25℃,101KPa 下,11.2L CO2中所含氧原子个数小于NA | |
| D. | 2.7gAl与足量稀盐酸反应,转移0.2NA个电子 |
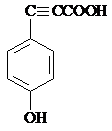 .
.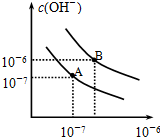 已知水在25℃和95℃时,其电离平衡曲线如图所示:
已知水在25℃和95℃时,其电离平衡曲线如图所示:

 .
. .
. .
.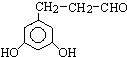 、
、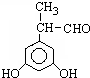 .
. (其中X、Y均部位H)
(其中X、Y均部位H)