题目内容
由主要成分是碳酸钡、碳酸钙组成的矿石样品,某课外活动小组欲从该样品中分离出碳酸钡,并尽可能除去Ca2+。供实验参考的数据见下表。
|
溶解度
物质 |
0℃ |
50℃ |
80℃ |
|
Ca(OH)2 |
0.173g |
0.130g |
0.094g |
|
Ba(OH)2 |
1.64g |
13.1g |
101.5g |
分离过程中用到的试剂有:矿石,水,不能再用其他试剂;要求将矿石经如下四步反应或操作后得到较纯净的碳酸钡。
![]()
试回答下列问题:
(1)在括号中填入实验的条件或方法:①________,②________。
(2)在方框中填入相应物质的化学式:b________,c________。
(3)写出有关反应的化学方程式:
b→c:________。
c→BaCO3:________。
解析:
(1)①高温; ②80℃的H2O (2)b:CaO、BaO; c:Ca(OH)2、Ba(OH)2 (3)b→c:CaO+H2O= Ca(OH)2,BaO+H2O= Ba(OH)2; c→BaCO3: Ba(OH)2+CO2=BaCO3↓+H2O
|
提示:
在高温时碳酸钡与碳酸钙都分解成相应的氧化物,氧化物溶于水后生成相应的碱。由于随着温度的升高,氢氧化钙的溶解度减小,氢氧化钡的溶解度明显增加,因此可以通过升高温度来除去其中的氢氧化钙。
|

 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案|
溶解度
物质 |
0℃ |
50℃ |
80℃ |
|
Ca(OH)2 |
0.173g |
0.130g |
0.094g |
|
Ba(OH)2 |
1.64g |
13.1g |
101.5g |
分离过程中用到的试剂有:矿石,水,不能再用其他试剂;要求将矿石经如下四步反应或操作后得到较纯净的碳酸钡。
![]()
试回答下列问题:
(1)在括号中填入实验的条件或方法:①________,②________。
(2)在方框中填入相应物质的化学式:b________,c________。
(3)写出有关反应的化学方程式:
b→c:________。
c→BaCO3:________。
BaSO4在水中存在沉淀溶解平衡BaSO4(s) Ba2+(aq)+SO42-(aq),溶度积常数Ksp=c(Ba2+)·c(SO42-)。
Ba2+(aq)+SO42-(aq),溶度积常数Ksp=c(Ba2+)·c(SO42-)。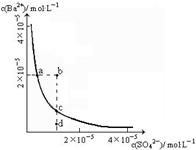
(1)某温度时,BaSO4的沉淀溶解平衡曲线如图所示。下列说法正确的是______
| A.加入Na2SO4可以使溶液由a点变到b点 |
| B.通过蒸发可以使溶液由d点变到c点 |
| C.d点无BaSO4沉淀生成 |
| D.a点对应的Ksp大于c点对应的Ksp |
①Ba2+是一种有毒的重金属离子,当人体中c(Ba2+)达到2×10—3mol·L-1时,就会对健康产生危害。硫酸钡作为“钡餐”的理由 。
②在25℃时,1L水中约能溶解0.0197g碳酸钡,且胃液是酸性的, (填“能”或“不能”)用碳酸钡代替硫酸钡作为“钡餐”,理由是

 BaSO4在水中存在沉淀溶解平衡BaSO4(s)═Ba2+(aq)+SO42-(aq),溶度积常数Ksp=c(Ba2+)?c(SO42-).
BaSO4在水中存在沉淀溶解平衡BaSO4(s)═Ba2+(aq)+SO42-(aq),溶度积常数Ksp=c(Ba2+)?c(SO42-).