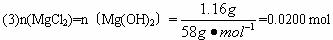题目内容
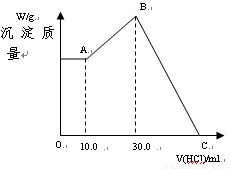
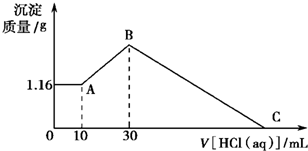
 把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后有1.16g白色沉淀,在所得悬浊液中逐滴加入1mol?L-1 HCl溶液,加入HCl溶液的体积与生成沉淀的质量关系如图所示,试回答:
把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后有1.16g白色沉淀,在所得悬浊液中逐滴加入1mol?L-1 HCl溶液,加入HCl溶液的体积与生成沉淀的质量关系如图所示,试回答:(1)A点的沉淀物的化学式为
Mg(OH)2
Mg(OH)2
;AB段反应的离子方程式为H2O+AlO2-+H+=Al(OH)3↓
H2O+AlO2-+H+=Al(OH)3↓
?(2)Q点溶液中的阳离子有
Na+、Mg2+、Al3
Na+、Mg2+、Al3
(3)原混合物AlCl3的质量是
2.67
2.67
g,NaOH的质量是5.2
5.2
g?分析:先分段分析图象,分析每一段图象发生的化学反应有哪些、拐点溶液中溶质的成分是什么,然后结合方程式、原子守恒求出各个物理量:
0-10ml,随盐酸的体积增加,生成沉淀的质量不变,说明氢氧化钠剩余,所以A点沉淀是Mg(OH)2,NaOH有剩余,溶液是NaCl、NaAlO2和NaOH的混合液,该阶段发生反应是:NaOH+HCl=NaCl+H2O;
②10ml处,加入10ml盐酸刚好中和未反应的NaOH,溶液为NaCl、NaAlO2;
③10ml-30ml,即A点→B点,随盐酸的体积增加,生成沉淀的质量增加,该阶段发生反应是:NaAlO2+HCl+H2O=Al(OH)3↓+NaCl,离子方程式是:H2O+AlO2-+H+=Al(OH)3↓
④30ml处,NaAlO2与盐酸恰好反应,需盐酸体积为:30ml-10ml=20ml,沉淀质量达到最大,溶液为NaCl溶液;
⑤30ml-Q点,随盐酸的体积增加,沉淀的质量减少,发生反应是:Mg(OH)2+2HCl=MgCl2+2H2O;Al(OH)3+3HCl=AlCl3+3H2O;
⑥Q点,Mg(OH)2和Al(OH)3完全反应,溶液为MgCl2、AlCl3和NaCl混合液.
0-10ml,随盐酸的体积增加,生成沉淀的质量不变,说明氢氧化钠剩余,所以A点沉淀是Mg(OH)2,NaOH有剩余,溶液是NaCl、NaAlO2和NaOH的混合液,该阶段发生反应是:NaOH+HCl=NaCl+H2O;
②10ml处,加入10ml盐酸刚好中和未反应的NaOH,溶液为NaCl、NaAlO2;
③10ml-30ml,即A点→B点,随盐酸的体积增加,生成沉淀的质量增加,该阶段发生反应是:NaAlO2+HCl+H2O=Al(OH)3↓+NaCl,离子方程式是:H2O+AlO2-+H+=Al(OH)3↓
④30ml处,NaAlO2与盐酸恰好反应,需盐酸体积为:30ml-10ml=20ml,沉淀质量达到最大,溶液为NaCl溶液;
⑤30ml-Q点,随盐酸的体积增加,沉淀的质量减少,发生反应是:Mg(OH)2+2HCl=MgCl2+2H2O;Al(OH)3+3HCl=AlCl3+3H2O;
⑥Q点,Mg(OH)2和Al(OH)3完全反应,溶液为MgCl2、AlCl3和NaCl混合液.
解答:解:向所得浊液中,逐滴加入1mol/L盐酸,由加入盐酸的体积和生成沉淀的质量关系图分析:
①NaOH、AlCl3、MgCl2组成的混合物,溶于足量水发生反应是:MgCl2+2NaOH=Mg(OH)2↓+2NaCl;AlCl3+4NaOH=NaAlO2+3NaCl+2H2O,
0-10ml,随盐酸的体积增加,生成沉淀的质量不变,说明氢氧化钠剩余,所以A点沉淀是Mg(OH)2,m[Mg(OH)2]=1.16g,物质的量是n=
mol=0.02mol,NaOH有剩余,溶液是NaCl、NaAlO2和NaOH的混合液,该阶段发生反应是:NaOH+HCl=NaCl+H2O;
②10ml处,加入10ml盐酸刚好中和未反应的NaOH,溶液为NaCl、NaAlO2;
③10ml-30ml,即A点→B点,随盐酸的体积增加,生成沉淀的质量增加,该阶段发生反应是:NaAlO2+HCl+H2O=Al(OH)3↓+NaCl,离子方程式是:H2O+AlO2-+H+=Al(OH)3↓
④30ml处,NaAlO2与盐酸恰好反应,需盐酸体积为:30ml-10ml=20ml,沉淀质量达到最大,溶液为NaCl溶液;
⑤30ml-Q点,随盐酸的体积增加,沉淀的质量减少,发生反应是:Mg(OH)2+2HCl=MgCl2+2H2O;Al(OH)3+3HCl=AlCl3+3H2O;
⑥Q点,Mg(OH)2和Al(OH)3完全反应,溶液为MgCl2、AlCl3和NaCl混合液.
(1)A点的沉淀物为氢氧化镁,其化学式为Mg(OH)2;AB段反应的离子方程式为H2O+AlO2-+H+=Al(OH)3↓,故答案为:Mg(OH)2;H2O+AlO2-+H+=Al(OH)3↓;
(2)根据⑥Q点溶液为MgCl2、AlCl3和NaCl混合液,其中的阳离子有Na+、Mg2+、Al3,故答案为:Na+、Mg2+、Al3;
(3)选30ml处,计算NaOH的质量,此时,溶液为NaCl溶液,溶液中Cl-来源于原混合物中的AlCl3、MgCl2和加入的30mlHCl,溶液中Na+来源于原混合物中的NaOH.
NaAlO2 +HCl+H2O=Al(OH)3↓+NaCl
0.02mol 0.02L×1mol/L
由Al原子守恒得原混合物中n(AlCl3)=n(NaAlO2)=0.02mol,质量m=0.02mol×133.5g/mol=2.67g.
由Mg原子守恒得原混合物中n(MgCl2)=n[Mg(OH)2]=0.02mol,
由Na+离子和Cl-离子守恒得,原混合物中
n(NaOH)=n(NaCl)=n(Cl-)=2n(MgCl2)+3n(AlCl3)+n(HCl)=0.02mol×2+0.02mol×3+0.03L×1mol/L=0.13mol,所以NaOH的质量是5.2g,故答案为:2.67;5.2.
①NaOH、AlCl3、MgCl2组成的混合物,溶于足量水发生反应是:MgCl2+2NaOH=Mg(OH)2↓+2NaCl;AlCl3+4NaOH=NaAlO2+3NaCl+2H2O,
0-10ml,随盐酸的体积增加,生成沉淀的质量不变,说明氢氧化钠剩余,所以A点沉淀是Mg(OH)2,m[Mg(OH)2]=1.16g,物质的量是n=
| 1.16 |
| 58 |
②10ml处,加入10ml盐酸刚好中和未反应的NaOH,溶液为NaCl、NaAlO2;
③10ml-30ml,即A点→B点,随盐酸的体积增加,生成沉淀的质量增加,该阶段发生反应是:NaAlO2+HCl+H2O=Al(OH)3↓+NaCl,离子方程式是:H2O+AlO2-+H+=Al(OH)3↓
④30ml处,NaAlO2与盐酸恰好反应,需盐酸体积为:30ml-10ml=20ml,沉淀质量达到最大,溶液为NaCl溶液;
⑤30ml-Q点,随盐酸的体积增加,沉淀的质量减少,发生反应是:Mg(OH)2+2HCl=MgCl2+2H2O;Al(OH)3+3HCl=AlCl3+3H2O;
⑥Q点,Mg(OH)2和Al(OH)3完全反应,溶液为MgCl2、AlCl3和NaCl混合液.
(1)A点的沉淀物为氢氧化镁,其化学式为Mg(OH)2;AB段反应的离子方程式为H2O+AlO2-+H+=Al(OH)3↓,故答案为:Mg(OH)2;H2O+AlO2-+H+=Al(OH)3↓;
(2)根据⑥Q点溶液为MgCl2、AlCl3和NaCl混合液,其中的阳离子有Na+、Mg2+、Al3,故答案为:Na+、Mg2+、Al3;
(3)选30ml处,计算NaOH的质量,此时,溶液为NaCl溶液,溶液中Cl-来源于原混合物中的AlCl3、MgCl2和加入的30mlHCl,溶液中Na+来源于原混合物中的NaOH.
NaAlO2 +HCl+H2O=Al(OH)3↓+NaCl
0.02mol 0.02L×1mol/L
由Al原子守恒得原混合物中n(AlCl3)=n(NaAlO2)=0.02mol,质量m=0.02mol×133.5g/mol=2.67g.
由Mg原子守恒得原混合物中n(MgCl2)=n[Mg(OH)2]=0.02mol,
由Na+离子和Cl-离子守恒得,原混合物中
n(NaOH)=n(NaCl)=n(Cl-)=2n(MgCl2)+3n(AlCl3)+n(HCl)=0.02mol×2+0.02mol×3+0.03L×1mol/L=0.13mol,所以NaOH的质量是5.2g,故答案为:2.67;5.2.
点评:对于图象分析题的解题规律:要明确每一段图象发生的化学反应、知道拐点代表的含义及溶液中溶质的成分,结合方程式对有关问题进行分析.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
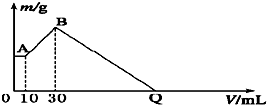
 把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后有1.16g白色沉淀,在所得的悬浊液中逐滴加入1mol?L-1 HCl溶液,加入HCl溶液的体积V与生成沉淀的质量m的关系如图所示,试回答:?
把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后有1.16g白色沉淀,在所得的悬浊液中逐滴加入1mol?L-1 HCl溶液,加入HCl溶液的体积V与生成沉淀的质量m的关系如图所示,试回答:?