题目内容
12.已知短周期元素的离子,${\;}_{a}^{\;}$A2+,${\;}_{b}^{\;}$B-具有相同的电子层结构,则下列叙述正确的是( )| A. | 原子半径B>A | B. | 原子序数a>b | C. | 离子半径B->A2+ | D. | a=b-3 |
分析 短周期元素的离子aA2+、bB-具有相同的电子层结构,则a-2=b+1,A处于第ⅡA族,若A为Be,则B为H,若A为Mg,则B为F,以此解答该题.
解答 解:短周期元素的离子aA2+、bB-具有相同的电子层结构,则a-2=b+1,A处于第ⅡA族,若A为Be,则B为H,若A为Mg,则B为F.
A.若A为Be,则B为H;若A为Mg,则B为F,两种情况原子半径A>B,故A错误;
B.由上述分析可知,A处于B的下一周期,原子序数a>b,故B正确;
C.由上述分析可知,核电荷数A>B,电子层结构相同,核电荷数越大,离子半径越小,所以离子半径B->A2+,故C正确;
D.aA2+、bB-具有相同的电子层结构,则a-2=b+1,即a=b+3,故D错误.
故选BC.
点评 本题考查位置结构性质的相互关系及应用,根据核外电子排布确定元素所在周期表中的位置,清楚元素周期律的递变规律是解答该题的关键,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
2.已知4NH3(g)+5O2(g)═4NO(g)+6H2O(g),若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,则正确的关系式为( )
| A. | 4v(NH3)=5v(O2) | B. | 5v(O2)=6v(H2O) | C. | 4v(O2)=5v(NO) | D. | 2v(NH3)=3v(H2O) |
3.电解稀H2SO4、CuCl2的混合液,最初一段时间阴极和阳极上分别析出的物质分别是( )
| A. | H2和Cl2 | B. | Cu和 Cl2 | C. | H2和O2 | D. | Cu和O2 |
20.下列措施或事实不能用勒夏特列原理解释的是( )
| A. | 新制的氯水在光照下颜色变浅 | |
| B. | H2、I2、HI平衡混合气减小压强(扩大体积)可使颜色变浅 | |
| C. | 打开汽水瓶盖,有气泡冒出 | |
| D. | 在合成氨的反应中,加压有利于氨的合成 |
7.下列各有机物的系统命名正确的是( )
| A. | 2,3,3-三甲基丁烷 | B. | 2-乙基丙烷 | ||
| C. | 2-甲基-2-丁烯 | D. | 2,2-二甲基-1,3-丁二烯 |
17.与CH2=CH2→CH2Br-CH2Br的变化属于同一反应类型的是( )
| A. | CH3COOH→CH3COOC2H5 | B. | C2H5Cl→CH2=CH2 | ||
| C. | 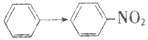 | D. | CH3CHO→C2H5OH |
1.下列各组物质中,反应后生成碱和氧气的是( )
| A. | 钾和水 | B. | 氧化钠和水 | C. | 氧化钙和水 | D. | 过氧化钠和水 |
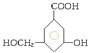
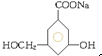 .
.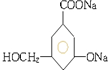 .
.
 O2(g)═CO(g)△H2,则△H1<△H2
O2(g)═CO(g)△H2,则△H1<△H2