题目内容
2007年1月25日,北京一食品厂突然发生氨气泄漏,500余名居民被紧急疏散,其中一名老人在疏散时被氨气熏倒.资料显示:“氨气可在纯氧中安静燃烧……”某校化学小组学生设计如下装置(图中铁夹等夹持装置已略去)进行氨气与氧气在不同条件下反应的实验.
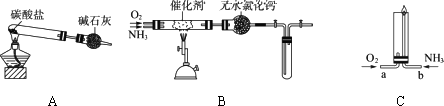
(1)用装置A制取纯净、干燥的氨气,大试管内碳酸盐的化学式是________;碱石灰的作用是________.
(2)将产生的氨气与过量的氧气通到装置B(催化剂为铂石棉)中,用酒精喷灯加热:
①氨催化氧化的化学方程式是________;试管内气体变为红棕色,该反应的化学方程式是________.
②停止反应后,立即关闭B中两个活塞.一段时间后,将试管浸入冰水中生成了一种二倍于NO2相对分子质量的化合物,试管内气体颜色变浅,请结合化学方程式说明原因________.
(3)将过量的氧气与A产生的氨气分别从a、b两管进气口通入到装置C中,在b管上端点燃氨气未见红棕色气体生成.
①两气体通入的先后顺序是________,其理由是________.
②氨气燃烧的化学方程式是________.
解析:
|
答案:(1)(NH4)2CO3或NH4HCO3 吸收反应生成的CO2和H2O (2)①4NH3+5O2 2NO+O2 ②可大胆推测,二倍于NO2相对分子质量的化合物是N2O4,它可能是无色的,而且低温有利它的生成.试管内颜色变浅,说明NO2不能完全转化为N2O4,所以NO2生成N2O4的反应方程式应是:2NO2 (3)①应先通入氧气,后通入氨气 否则难以点燃,而且氨气易污染空气 ②4NH3+3O2 解析:(1)制氨气的碳酸盐毫无疑问是(NH4)2CO3或NH4HCO3.(NH4)2CO3或(NH4)HCO3加热分解的化学方程式为:(NH4)2CO3 显然,碱石灰的作用是吸收CO2和H2O. (2)①氨与氧气在铂催化剂的作用下燃烧,产物是NO和H2O(这是氨氧化法制硝酸的第一步),后续现象也说明了这一点. 4NH3+5O2 试管内变红棕色,肯定是NO被氧化成的NO2:2NO+O2 ②可大胆推测,二倍于NO2相对分子质量的化合物是N2O4,它可能是无色的,而且低温有利于它的生成.试管内颜色变浅,说明NO2不能完全转化为N2O4,所以NO2生成N2O4的反应方程式应是:2NO2 (3)①应先通入氧气,后通入氨气,否则难以点燃,而且氨气易污染空气. ②氨在没有催化剂的情况下燃烧,且未见有红棕色气体生成,肯定不是生成NO,而应当是氮气.4NH3+3O2 |

|
2007年3月12日,上海浦东一溶剂厂工地内发生氯气罐泄漏,浅黄绿色的氯气使在场61名工人分别受到不同程度的伤害.2007年1月25日,北京一食品厂突然发生氨气泄漏,500余名居民被紧急疏散,其中一名老人在疏散时被氨气熏倒. 下列有关氯气、氨气的说法正确的是 | |
| [ ] | |
A. |
氯气和氨气都是易液化的气体 |
B. |
氯气和氨气都是无色、密度比空气大的有毒气体 |
C. |
氯气和氨气都对人体无害 |
D. |
金属都能够与氯气剧烈反应但氨气不能 |