��Ŀ����
| 10-9 |
| x-10-2 |
| 10-9 |
| x-10-2 |
��2�����������һ�����Ϳɳ���أ�����ͨ���ܵ����ȣ��õ���ܳ�ʱ�䱣���ȶ��ķŵ��ѹ��������ص��ܷ�ӦΪ3Zn+2K2FeO4+8H2O
| �ŵ� |
| ��� |
��д���õ�س��ʱ���������ĵ缫��Ӧʽ
������
������
������������ȷ����
A��Zn�缫�ڷŵ�ʱ������������������Ӧ
B���õ�طŵ�ʱ��K+���ƶ�
C���ŵ�ʱ������1molK2FeO4����ԭ����ת��3mol���ӣ�
���øõ�ص��200mL 1mol?L-1 ��AgNO3��Һ���ö��Ե缫������������������2.16gʱ���������Һ��pHΪ
��3�����ֳ�����������Һ�п�ʼ����ʱ��pH���±���
| ���� | Fe2+ | Cu2+ | Mg2+ |
| pH | 7.6 | 5.2 | 10.4 |
| c(CH3COO-)��C(H+) |
| C(CH3COOH) |
��2���ٳ��ʱ��������������п�õ��ӷ�����ԭ��Ӧ����������������ʧ���ӷ���������Ӧ��
�ڷŵ�ʱ��ʧ���ӵĵ缫�������������Ϸ���������Ӧ���õ��ӵĵ缫�������������Ϸ�����ԭ��Ӧ���������������ƶ������������ƶ���
�۸��������������������Ũ�ȣ��Ӷ��ó�����Һ��pH��
��3��pHС�������ȳ������ܶȻ�����ԽС������Խ�ȳ�����
| c(CH3COO-)��C(H+) |
| C(CH3COOH) |
| x |
| 2 |
| 10-9 |
| x-10-2 |
| 10-9 |
| x-10-2 |
��2���ٳ��ʱ��������������п�õ��ӷ�����ԭ��Ӧ���缫��ӦʽΪ��Zn��OH��2+2e-=Zn+2OH-����������������ʧ���ӷ���������Ӧ���缫��ӦʽΪ��Fe��OH��3-3e-+5OH-=FeO42-+4H2O��
�ʴ�Ϊ��������Zn��OH��2+2e-=Zn+2OH-��������Fe��OH��3-3e-+5OH-=FeO42-+4H2O��
��A��Zn�缫�ڷŵ�ʱ��������������ʧ���ӷ���������Ӧ������ȷ��
B���õ�طŵ�ʱ��K+�������ƶ����ʴ���
C���ŵ�ʱ������1molK2FeO4����ԭ����ת��1mol��6-3��=3mol���ӣ�����ȷ��
��ѡAC��
��4AgNO3+2 H2O
| ||
| ||
| 0.2L |
�ʴ�Ϊ��1��
��3��pHС�������ȳ������ܶȻ�����ԽС������Խ�ȳ���������Cu2+�ȳ�����KSP[��Fe��OH��2]��KSP[��Mg��OH��2]��
�ʴ�Ϊ��Cu2+������

 ���źþ���Ԫ����ĩ��ϵ�д�
���źþ���Ԫ����ĩ��ϵ�д�X��YΪ��������Ԫ�أ�ԭ������XС��Y��������Ԫ��Se����Ԫ��ԭ������֮��Ϊ56����֪��X������������M��N��Y��Se����������ͬ����Ԫ�أ�����Se���Դӵ�⾫��ͭ���������л�á�������������ȡSe���������£�

�ش��������⣺����Ԫ������Ӧ��Ԫ�ط��ű�ʾ��
��д��X��Y�γɵĻ�����ĵ���ʽ ��
����������Se�Ե��ʡ�Ag2Se��Cu2Se����ʽ���ڡ�д������Se������Ũ���ᷴ
Ӧ�Ļ�ѧ����ʽ
��д����Ӧ�ڵĻ�ѧ����ʽΪ ��
��ij�¶������ݻ��̶����ܱ������У����з�Ӧ�ﵽƽ�⣺
M(g)+H2O(g) N(g)+H2(g)
N(g)+H2(g)
|
n(M):n(H2O) |
Mת���� |
H2Oת���� |
|
1��1 |
0.5 |
0.5 |
|
1��2 |
0.67 |
0.335 |
|
1��3 |
0.75 |
0.25 |
����֪M��H2��ȼ���ȷֱ�Ϊ283kJ/mol��285.8kJ/mol��H2O��g��=H2O(l)��H=
��44kJ/mol��д��������Ӧ���Ȼ�ѧ����ʽ ��
�ڸ÷�Ӧ��ƽ�ⳣ��Ϊ �����¶��£��������г���1molM��3mol H2O��
2mol N��1.5molH2������ʼʱ�÷�Ӧ����V�� V�����>������<����=����
�۽�ϱ��������ж�����˵������ȷ����
A������H2O��g��������M��ת�������߶�H2O��g����ת���ʽ���
B����M��H2O��g����ת������ͬʱ�����ߵij�ʼͶ����һ����ͬ
C��M��H2O��g����ʼ���ʵ���֮�ȵ��ڶ���ת����֮��
D����M��H2O��g�����ʵ�֮��Ϊ1��4ʱ��M��ת����Ϊ0.85
X��YΪ��������Ԫ�أ�ԭ������XС��Y��������Ԫ��Se����Ԫ��ԭ������֮��Ϊ56����֪��X������������M��N��Y��Se����������ͬ����Ԫ�أ�����Se���Դӵ�⾫��ͭ���������л�á�������������ȡSe���������£�
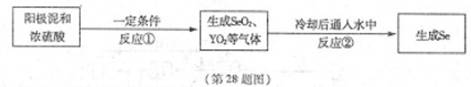
�ش��������⣺����Ԫ������Ӧ��Ԫ�ط��ű�ʾ��
��1��д��X��Y�γɵĻ�����ĵ���ʽ ��
��2����������Se�Ե��ʡ�Ag2Se��Cu2Se����ʽ���ڡ�д������Se������Ũ���ᷴӦ�Ļ�ѧ����ʽ ��
��3��д����Ӧ�ڵĻ�ѧ����ʽΪ ��
��4��ij�¶������ݻ��̶����ܱ������У����з�Ӧ�ﵽƽ�⣺M(g)+H2O(g) N(g)+H2(g)
N(g)+H2(g)
|
n(M):n(H2O) |
Mת���� |
H2Oת���� |
|
1��1 |
0.5 |
0.5 |
|
1��2 |
0.67 |
0.335 |
|
1��3 |
0.75 |
0.25 |
����֪M��H2��ȼ���ȷֱ�Ϊ283kJ/mol��285.8kJ/mol��H2O��g��=H2O(l)��H=��44kJ/mol��
д��������Ӧ���Ȼ�ѧ����ʽ ��
�ڸ÷�Ӧ��ƽ�ⳣ��Ϊ �����¶��£��������г���1molM��3mol H2O��2mol N��1.5molH2������ʼʱ�÷�Ӧ����V�� V�����>������<����=����
�۽�ϱ��������ж�����˵������ȷ����
A������H2O��g��������M��ת�������߶�H2O��g����ת���ʽ���
B����M��H2O��g����ת������ͬʱ�����ߵij�ʼͶ����һ����ͬ
C��M��H2O��g����ʼ���ʵ���֮�ȵ��ڶ���ת����֮��
D����M��H2O��g�����ʵ�֮��Ϊ1��4ʱ��M��ת����Ϊ0.85
��֪�ڳ����²��Ũ�Ⱦ�Ϊ0.1mol/L������6����Һ��pH��
| ���� | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 8.1 | 11.6 | 10.3 | 11.1 | 11.3 |
A��CO2+H2O+2NaClO�TNa2CO3+2HClO
B��CO2+H2O+NaClO�TNaHCO3+HClO
C��CO2+H2O+C6H5ONa-��NaHCO3+C6H5OH
D��CO2+H2O+2C6H5ONa-��Na2CO3+2C6H5OH
E��Na2CO3+C6H5OH-��NaHCO3+C6H5ONa
F��CH3COOH+NaCN�TCH3COONa+HCN
��2��һЩ���ֽⷴӦ�ķ�������ѭ�����Ĺ��ɣ����б仯�����ڸ��ֽⷴӦ��
�ٽ�ʯ�����봿����Һ��Ͽ��Ƶÿ�������Һ
����̼�������Һ�м��뱥��ʳ��ˮ�ɻ��С�մ����
������KCl��NaNO3�Ļ����Һ����������NaCl���壮
����������Ӧ���ܽ�����ֽⷴӦ��������һ����Ϊ______��
��3�����ʵ���Ũ�Ⱦ�Ϊ0.05mol/L�������������ʵ���Һ�У�pH�ɴ�С��˳����______�����ţ���
��C6H5OH�����ӣ� ��CH3COOH ��HClO4 ��HClO ��H2SO4
��4��һ���¶��£���������ˮ�зֱ��������ʵ������������ʣ���NaOH����CH3COOH����NaClO����ˮ�ĵ���̶�������______�����ţ���
��5��25��ʱ��M����Һ��pH=a��N����Һ��pH=b��
����XΪǿ�ᣬYΪǿ���a+b=14�������ߵ������Ϻ���Һ��pH=______����ʱ��Һ�н���������Ũ�ȴ������������Ũ�ȣ���ԭ�������______��
����X�Ļ�ѧʽΪHR��Y�Ļ�ѧʽΪMOH����a+b=14�����ߵ������Ϻ���Һ�����ԣ�������Һ�бض���һ�������ܷ���ˮ�⣬������Ϊ______�������ӷ��ţ�����Ϻ����Һ�У�������Ũ�ȴ�С��ϵ��ȷ����______������ţ���
a c��MOH����c��M+����c��R-����c��H+����c��OH-��
b c��HR����c��M+����c��R-����c��OH-����c��H+��
c c��R-����c��M+����c��H+����c��OH-��
d c��M+����c��R-����c��OH-����c��H+��
e c��M+��+c��H+��=c��R-��+c��OH-��