题目内容
【题目】海藻中含有丰富的、以离子形式存在的碘元素。下图是实验室从海藻里提取碘的流程中的一部分。
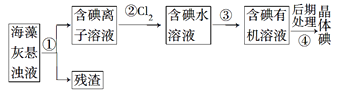
下列判断正确的是
A. 步骤①③的操作分别是过滤、萃取
B. 可用淀粉溶液检验步骤②的反应是否进行完全
C. 步骤③中加入的有机溶剂是裂化汽油或乙醇
D. 步骤④的操作是过滤
【答案】A
【解析】
试题A.分离固体和液体用过滤,从水溶液中提取碘一般用萃取的方法,A正确;B.步骤②的反应为:Cl2+2I![]() =2Cl
=2Cl![]() +I2,因此不能用淀粉溶液检验步骤②的反应是否进行完全,B错误;C.萃取剂不能和溶质反应,且萃取剂和原溶剂不能互溶,由于乙醇和水互溶,乙醇不能作萃取剂,C错误;D.碘易溶于有机溶剂,所以不能过滤,应该用蒸馏的方法提取碘,D错误。答案选A。
+I2,因此不能用淀粉溶液检验步骤②的反应是否进行完全,B错误;C.萃取剂不能和溶质反应,且萃取剂和原溶剂不能互溶,由于乙醇和水互溶,乙醇不能作萃取剂,C错误;D.碘易溶于有机溶剂,所以不能过滤,应该用蒸馏的方法提取碘,D错误。答案选A。

 学习实践园地系列答案
学习实践园地系列答案【题目】下列实验现象描述错误的是
编号 | 实验 | 现象 |
A | 加热放在坩埚中的小块钠 | 钠先熔化成光亮的小球,燃烧时,火焰为黄色,燃烧后,生成淡黄色固体 |
B | 在酒精灯上加热用砂纸打磨过的铝箔 | 铝箔变软,失去光泽,熔化的铝并不滴落 |
C | 在FeCl2溶液中滴入NaOH溶液 | 生成白色沉淀,沉淀很快变为灰绿色,最后变为红褐色 |
D | 将水蒸气通过灼热的铁粉 | 黑色粉末变为红褐色 |
A. A B. B C. C D. D
【题目】下列实验方案、现象、得出的结论均正确的是
选项 | 实验及现象 | 结论 |
A | 向SiO2固体加入过量盐酸振荡,固体不溶解 | SiO2不溶于任何酸 |
B | 用玻璃棒蘸取某样品进行焰色反应时观察到黄色火焰 | 该样品含钠元素 |
C | 向酸化的KMnO4溶液通入SO2,向反应后的溶液中加入BaCl2产生白色沉淀 | 白色沉淀为BaSO3 |
D | 将镁条点燃,迅速伸入集满CO2的集气瓶有白色固体和黑色颗粒产生 | CO2具有氧化性 |
A. A B. B C. C D. D
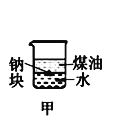
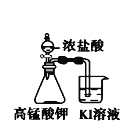
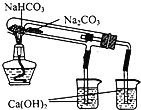
【题目】下列装置所示的实验中,不能达到实验目的是
|
|
|
|
A.长时间看到Fe(OH)2白色沉淀 | B.证明ρ(煤油)< ρ(钠) < ρ(水) | C.探究氧化性: KMnO4>Cl2>I2 | D.比较NaHCO3、Na2CO3的热稳定性 |
A. A B. B C. C D. D
【题目】在80℃时,将0.4mol的四氧化二氮气体充入2L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:反应进行至100s后将反应混合物的温度降低,发现气体的颜色变浅.
时间(s) c(mol/L) | 0 | 20 | 40 | 60 | 80 | 100 |
c(N2O4) | 0.20 | a | 0.10 | c | d | e |
c(NO2) | 0.00 | 0.12 | b | 0.22 | 0.22 | 0.22 |
(1)表中b_____c(填“<”、“=”、“>”).
(2)20s时,N2O4的浓度为_____mol/L,0~20s内N2O4的平均反应速率为_________.
(3)该反应在80℃时该反应的平衡常数K值为_______(保留2位小数).
【题目】将物质X逐渐加入(或滴入)Y溶液中,其生成沉淀的物质的量与加入X的物质的量关系如图所示,符合图示情况的是( )
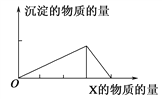
A | B | C | D | |
X | NaOH | HCl | CO2 | AlCl3 |
Y | AlCl3 | NaAlO2 | Ca(OH)2 | NaOH |
A. A B. B C. C D. D