题目内容
【题目】某温度时,在一个2L的密闭容器中,X、Y、Z三种气体物质的物质的量随时间的变化曲线如图所示.下列说法不正确的是( )

A. 该反应的化学方程式为3X+Y![]() 2Z
2Z
B. 容器内混合气体的平均摩尔质量保持不变表明该反应一定达到平衡状态
C. 平衡时,体系的压强是开始时的1.8倍
D. 平衡时,Y的体积分数为50%
【答案】C
【解析】由图象可以看出,反应中X、Y的物质的量减小,Z的物质的量增多,则X、Y为反应物,Z为生成物,且△n(X):△n(Y):△n(Z)=0.3mol:0.1mol:0.2mol=3:1:2,则反应的化学方程式为3X+Y![]() 2Z,故A正确;反应前后气体质量不变,物质的量减小,根据
2Z,故A正确;反应前后气体质量不变,物质的量减小,根据![]() ,平均摩尔质量是变量,平均摩尔质量保持不变,反应一定达到平衡状态,故B正确;恒温恒容,压强比等于系数比,压强是开始时的
,平均摩尔质量是变量,平均摩尔质量保持不变,反应一定达到平衡状态,故B正确;恒温恒容,压强比等于系数比,压强是开始时的![]() 0.9,故C错误;平衡时,Y的体积分数为
0.9,故C错误;平衡时,Y的体积分数为![]() 50%,故D正确。
50%,故D正确。

 千里马走向假期期末仿真试卷寒假系列答案
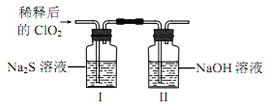
千里马走向假期期末仿真试卷寒假系列答案【题目】二氧化氯(ClO2)是极易溶于水且不与水发生化学反应的黄绿色气体,沸点为11℃,可用于处理含硫废水。某小组在实验室中探究ClO2与Na2S的反应。回答下列问题:
(l)ClO2的制备:(已知:SO2+2NaClO3+H2SO4=2ClO2↑+2NaHSO4)

①装置A中反应的化学方程式为_______________。
②欲收集干燥的ClO2,选择上图中的装置,其连接顺序为 a→_________(按气流方向,用小写字母表示)
③装置D的作用是_________。
(2)ClO2与 Na2S 的反应
将上述收集到的ClO2用 N2稀释以增强其稳定性,并将适量的稀释后的ClO2通入上图所示装置中充分反应,得到无色澄清溶液。一段时间后,通过下列实验探究 I 中反应的产物。
操作步骤 | 实验现象 | 结论 |
取少量Ⅰ中溶液于试管甲中, 加入Ba(OH)2溶液,振荡 | ①_________ | 有硫酸根离子生成 |
另取少量Ⅰ中溶液于试管乙中, 滴加品红溶液和盐酸 | 品红溶液不翅色 | ② 无_____生成 |
若在试管甲中继续加Ba(OH)2溶液至 过量,静置,取上层清液于试管丙③______ | 有白色沉淀生成 | 有Cl-生成 |
④ClO2与Na2S反应的离子方程式为__________。用于处理含硫废水时,ClO2相对于Cl2的优点是____________(任写2条)。
【题目】海水是巨大的资源宝库。下图是实验室模拟工业从海水资源获取某些重要化工原料的流程示意图。

回答下列问题:
(1)由于溴离子在海水中浓度很低(0.067g/L),要进行溴元素的浓缩、富集。实验室若要直接浓缩海水时,下面的仪器肯定不需要的是(填编号)__________
A.玻璃棒 B.三脚架 C.坩埚 D.蒸发皿 E.酒精灯
(2)要知道海水晒盐的过程中溶液里食盐含量在逐渐提高的简易方法是___________。
A.分析氯化钠含量 B.测定溶液密度 C.观察是否有沉淀析出
(3)写出溴水中通入SO2时反应的离子方程式____________。
(4)上图中虚线框内流程也可用![]() Na2CO3溶液吸收Br2的反应化学方程式补充完整:
Na2CO3溶液吸收Br2的反应化学方程式补充完整:
____Br2 + _____Na2CO3 = _____NaBrO3 +___________ +________
(5)现有一份吸收了溴的无色溶液(采用上述两种方法之一,且吸收剂和溴恰好完全反应),请你通过实验探究该溶液究竟是采用那种方法吸收溴的。
① 提出合理假设
假设1:采用纯碱吸收法,吸收液中含大量Na+、Br –、BrO3-
假设2:_____________________________________________。
② 设计方案、进行实验,验证假设:请在表中写出实验步骤以及预期现象和结论。限选实验试剂和仪器:10mL量筒、小烧杯、试管、胶头滴管;无水乙醇、苯、0.10mol/LAgNO3、0.10mol/LBaCl2、2mol/LHCl 查资料得:Ba(BrO3)2为白色固体,微溶于水
实验步骤 | 预期现象和结论 |
步骤1:用量筒取样品溶液2mL分别于A、B试管中,往A试管中加入___________。 | 若____________________________,则假设1一定能成立。 |
步骤2:往试管B中加入___________。 | 若_________________,则假设2一定能成立。 |