题目内容
(13分)实验室用下列方法测定某水样中O2的含量。

(1)实验原理
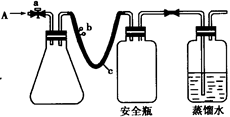
用如图所示装置,使溶解在水中的O2在碱性条件下将Mn2+氧化成MnO(OH)2,反应的离子方程式为 。
再用I-将生成的MnO(OH)2再还原为Mn2+,反应的离子方程式为: MnO(OH)2+2I—+4H+=Mn2++I2+3H2O。
然后用Na2S2O3 标准溶液滴定生成的I2,反应方程式为: I2+2Na2S2O3=2NaI+Na2S4O6。
(2)实验步骤
① 打开止水夹a 和b,从A 处向装置内鼓入过量N2,此操作的目的是 ;
② 用注射器抽取某水样20.00 mL从A 处注入锥形瓶;
③ 再分别从A 处注入含m mol NaOH溶液及过量的MnSO4 溶液;
④ 完成上述操作后,关闭a、b,将锥形瓶中溶液充分振荡;
⑤ 打开止水夹a、b,分别从A 处注人足量NaI溶液及含n mol H2SO4的硫酸溶液;
⑥ 重复④ 的操作。
⑦ 取下锥形瓶,向其中加入2~3滴 作指示剂;
⑧ 用0.005 mol · L—1Na2S2O3 滴定至终点。
(3)数据分析
①若滴定过程中消耗的Na2S2O3 标准溶液体积为3.90 mL,则此水样中氧(O2)的含量为 (单位:mg·L—1)。
②若未用Na2S2O3标准溶液润洗滴定管,则测得水样中O2的含量将 (填“偏大”、“偏小”或“不变”)。
③实验要求加入适量的H2SO4使溶液接近中性,其原因是 。
(1)2Mn2++O2+4OH-=2MnO(OH)2
(2)①赶走装置内空气,避免空气中的O2的干扰 ⑦淀粉溶液
(3)①7.8mg·L—1 (3分) ② 偏大
③若碱过量,则Mn(OH)2不能全部转变为Mn2+,而酸过量时,滴定过程中Na2S2O3可与酸反应
【解析】(1)注意从题给条件中挖掘信息:反应物有O2、OH-(在碱性条件下)、Mn2+,发生氧化还原反应,生成MnO(OH)2,利用化合价升降相等配平O2、Mn2+、MnO(OH)2系数,再利用电荷守恒配平OH-的系数,最后可用原子守恒检查方程式的配平是否正确;
(2)①—④完成后,发生2Mn2++O2+4OH-=2MnO(OH)2 ,
⑤—⑥完成后,发生MnO(OH)2+2I—+4H+=Mn2++I2+3H2O,
⑦—⑧完成后,发生I2+2Na2S2O3=2NaI+Na2S4O6,故⑦中淀粉做指示剂,颜色变化为蓝色变无色
(3)①根据(1)中的三个方程式,可以看出物质间的定量关系:
O2 →2 MnO(OH)2 → 2 I2 → 4 Na2S2O3,
即该题的思路是利用Na2S2O3溶液定量测定某水样中O2的含量;
O2 →→→→ 4 Na2S2O3,
1 4
n(O2) 0.005 mol · L—1×(3.90×10-3)L=1.95×10-5 mol
则n(O2)= 1.95×10-5 mol÷4=4.875×10-6 mol
此水样中氧(O2)的含量为[(4.875×10-6 mol)×32g.mol-1×1000mg.g-1]/0.02L=7.8mg·L—1;
②“若未用Na2S2O3标准溶液润洗滴定管”,则C(Na2S2O3)减小,V(Na2S2O3)增大即滴定管的读数增大,所以n(O2)增大,故测得水样中O2的含量将偏大;


 Ag+(aq)+Cl-(aq), 在25℃时,AgCl的Ksp=1.8×10-10
Ag+(aq)+Cl-(aq), 在25℃时,AgCl的Ksp=1.8×10-10