题目内容
5.下列关于CCl4用于萃取碘水中的碘的理由不正确的是( )| A. | CCl4比水轻 | |
| B. | CCl4与水和I2均不反应 | |
| C. | CCl4与原溶剂水互不相溶 | |
| D. | I2在CCl4中的溶解度比在水中大得多 |
分析 萃取剂的选择必须符合下列条件:溶质在萃取剂中的溶解度比在原溶剂中要大;萃取剂与原溶剂不相溶;萃取剂与溶质不反应.
解答 解:A.萃取剂必须不溶于水,但密度不一定比水小,故A错误;
B.萃取剂和水不互溶,且萃取剂和碘不反应,故B正确;
C.萃取剂与原溶剂不相溶,故C正确;
D.碘在萃取剂中的溶解度大于在水中的溶解度,故D正确.
故选A.
点评 本题考查了萃取剂的选择,难度不大,明确萃取剂的选择必须符合下列条件:溶质在萃取剂中的溶解度比在原溶剂中要大;萃取剂与原溶剂不相溶;萃取剂与溶质不反应.

练习册系列答案
相关题目
16.下列关于钠的叙述中,正确的是( )
| A. | 钠是淡黄色固体 | |
| B. | 钠的密度:小于煤油大于水 | |
| C. | 钠在化学反应中只能做还原剂 | |
| D. | 钠与硫酸铜溶液反应有红色的铜生成 |
13. 某稀硫酸和稀硝酸的混合溶液200ml,平均分成两份,向其中一份中逐渐加入铜粉,最多能溶解m g.向另一份中逐渐加入铁粉,产生的气体量随铁粉质量增加的变化如图所示(已知硝酸只被还原为NO气体)下列分析或结果错误的是( )
某稀硫酸和稀硝酸的混合溶液200ml,平均分成两份,向其中一份中逐渐加入铜粉,最多能溶解m g.向另一份中逐渐加入铁粉,产生的气体量随铁粉质量增加的变化如图所示(已知硝酸只被还原为NO气体)下列分析或结果错误的是( )
 某稀硫酸和稀硝酸的混合溶液200ml,平均分成两份,向其中一份中逐渐加入铜粉,最多能溶解m g.向另一份中逐渐加入铁粉,产生的气体量随铁粉质量增加的变化如图所示(已知硝酸只被还原为NO气体)下列分析或结果错误的是( )
某稀硫酸和稀硝酸的混合溶液200ml,平均分成两份,向其中一份中逐渐加入铜粉,最多能溶解m g.向另一份中逐渐加入铁粉,产生的气体量随铁粉质量增加的变化如图所示(已知硝酸只被还原为NO气体)下列分析或结果错误的是( )| A. | 第二份溶液中最终溶质为FeSO4 | B. | 原混合酸中NO3-物质的量为0.1mol | ||
| C. | m值为9.6 | D. | H2SO4浓度为2.5mol/L |
17.下列实验现象描述不正确的是( )
| A. | 细铁丝在氧气里点燃后剧烈燃烧,火星四射,产生黑色固体 | |
| B. | 氢气燃烧产生淡蓝色火焰 | |
| C. | 硫在空气中燃烧产生明亮的蓝紫色火焰,并生成有刺激性气味的气体 | |
| D. | 红磷在空气中燃烧产生大量白烟 |
 实验室配制500mL 0.2mol•L-1的Na2SO4溶液,实验操作步骤有:
实验室配制500mL 0.2mol•L-1的Na2SO4溶液,实验操作步骤有:

 .有人用图3所示装置制取消毒液(主要成分为NaClO),其中A极为阴极,B极为阳极,则阳极的产物为Cl2(填化学式).
.有人用图3所示装置制取消毒液(主要成分为NaClO),其中A极为阴极,B极为阳极,则阳极的产物为Cl2(填化学式). 化学小组的同学利用如图所示装置进行实验.集气瓶中装有纯净物A,分液漏斗中盛有物质B.
化学小组的同学利用如图所示装置进行实验.集气瓶中装有纯净物A,分液漏斗中盛有物质B. .
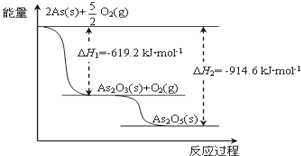
.
 ,则氨气的平衡转化率是75%.
,则氨气的平衡转化率是75%.