题目内容
对于第三周期元素的有关叙述错误的是
A.碱性:NaOH > Mg(OH)2 > Al(OH)3
B.电负性:Si < P < S
C.第一电离能:Na < Mg < Al
D.Cl-核外电子排布式:1s22s22p63s23p6
C
【解析】

 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案(11分)常用于除去高速公路冰雪的是“氯盐类”融雪剂,如NaCl、MgCl2等,请回答:
(1)“氯盐类”融雪剂主要成分的晶体类型为 ;
(2)冰比硫化氢熔点高的原因是 ,冰分子中氧原子的杂化轨道类型为 ;
(3)已知X、Y和Z为第三周期元素,其原子的第一至第四电离能如下表所示:
| 电离能/kJ·mol-1 | I1 | I2 | I3 | I4 |
| X | 578 | 1817 | 2745 | 11578 |
| Y | 738 | 1451 | 7733 | 10540 |
| Z | 496 | 4562 | 6912 | 9543 |
元素Y第一电离能大于X的原因是 ;
(4)融雪剂对环境危害很大,如和路基上的铁等金属形成原电池,加快路面破损。铁元素应用广泛,Fe2+与KCN溶液反应得Fe(CN)2沉淀,KCN过量时沉淀溶解,生成黄血盐,结构如图。
①写出铁元素基态原子价电子的轨道表示式 ;
②已知CN- 与 N2 结构相似,1 mol CN-中 键数目为 ;
键数目为 ;
【解析】(1)NaCl、MgCl2等均是由离子键形成的离子化合物,因此形成的晶体是离子晶体。
(2)水和硫化氢虽然都是分子晶体,但水分子中存在氢键,所以其熔点高于硫化氢的。水分子中的中心原子有4对电子对,其中2对是孤电子对,所以杂化轨道类型是sp3。
(3)气态电中性基态原子失去1个电子转化为气态基态正离子所需要的最低能量叫第一电离能。根据表中数据可判断X、Y、Z分别是Al、Mg、Na。由于Al是3p1,而Mg为3s2构型,此时3p0全空,特别稳定。
(4)①元素原子的最外层电子是价电子,对于副族和第Ⅷ元素其次外层或倒数第三层电子也可以成为价电子。铁属于第Ⅷ元素,其价电子轨道表达式是
②氮气中氮原子和氮原子形成的化学键是氮氮三键,而三键是由2个![]() 键和1个
键和1个![]() 键组成的。CN- 与 N2 结构相似,所以1 mol CN- 中
键组成的。CN- 与 N2 结构相似,所以1 mol CN- 中![]() 键数目为2NA。
键数目为2NA。
(11分)常用于除去高速公路冰雪的是“氯盐类”融雪剂,如NaCl、MgCl2等,请回答:
(1)“氯盐类”融雪剂主要成分的晶体类型为 ;
(2)冰比硫化氢熔点高的原因是 ,冰分子中氧原子的杂化轨道类型为 ;
(3)已知X、Y和Z为第三周期元素,其原子的第一至第四电离能如下表所示:
|
电离能/kJ·mol-1 |
I1 |
I2 |
I3 |
I4 |
|
X |
578 |
1817 |
2745 |
11578 |
|
Y |
738 |
1451 |
7733 |
10540 |
|
Z |
496 |
4562 |
6912 |
9543 |
元素Y第一电离能大于X的原因是 ;
(4)融雪剂对环境危害很大,如和路基上的铁等金属形成原电池,加快路面破损。铁元素应用广泛,Fe2+与KCN溶液反应得Fe(CN)2沉淀,KCN过量时沉淀溶解,生成黄血盐,结构如图。

①写出铁元素基态原子价电子的轨道表示式 ;
②已知CN- 与 N2 结构相似,1 mol CN-
中 键数目为
;
键数目为
;
【解析】(1)NaCl、MgCl2等均是由离子键形成的离子化合物,因此形成的晶体是离子晶体。
(2)水和硫化氢虽然都是分子晶体,但水分子中存在氢键,所以其熔点高于硫化氢的。水分子中的中心原子有4对电子对,其中2对是孤电子对,所以杂化轨道类型是sp3。
(3)气态电中性基态原子失去1个电子转化为气态基态正离子所需要的最低能量叫第一电离能。根据表中数据可判断X、Y、Z分别是Al、Mg、Na。由于Al是3p1,而Mg为3s2构型,此时3p0全空,特别稳定。
(4)①元素原子的最外层电子是价电子,对于副族和第Ⅷ元素其次外层或倒数第三层电子也可以成为价电子。铁属于第Ⅷ元素,其价电子轨道表达式是
②氮气中氮原子和氮原子形成的化学键是氮氮三键,而三键是由2个 键和1个
键和1个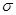 键组成的。CN- 与 N2 结构相似,所以1 mol CN- 中
键组成的。CN- 与 N2 结构相似,所以1 mol CN- 中 键数目为2NA。
键数目为2NA。