题目内容
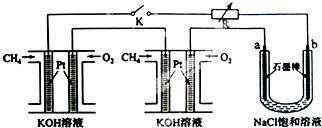
中学化学中下列各物质间不能实现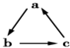 (“→”表示一步完成)转化的是( )
(“→”表示一步完成)转化的是( )
 (“→”表示一步完成)转化的是( )
(“→”表示一步完成)转化的是( )| A | B | C | D | |
| a | CH3CH2OH | CH2═CH2 | Cl2 | C |
| b | CH3CHO | CH3CH2Br | HClO | CO |
| c | CH3COOH | CH3CH2OH | HCl | CO2 |
| A、A | B、B | C、C | D、D |
考点:乙醇的化学性质,氯气的化学性质,乙烯的化学性质
专题:元素及其化合物,有机反应
分析:利用各物质的性质及变化规律,根据题图所示的物质的转化关系,分析两种物质的转化能否通过一步反应实现,注意各物质的性质.
解答:
解:A、乙醇氧化得到乙醛,乙醛氧化得到乙酸,但乙酸不能转变成乙醇,故A错误;
B、乙烯与溴化氢发生加成反应得到氯乙烷,氯乙烷水解得到乙醇,乙醇发生消去反应得到乙烯,故B正确;
C、氯气与水反应生成次氯酸和盐酸,次氯酸分解产生盐酸和氧气,浓盐酸与二氧化锰反应生成氯气,故C正确;
D、碳不完全燃烧生成一氧化碳,一氧化碳继续燃烧生成二氧化碳,二氧化碳与镁反应生成氧化镁和单质碳,故D正确;
故选A.
B、乙烯与溴化氢发生加成反应得到氯乙烷,氯乙烷水解得到乙醇,乙醇发生消去反应得到乙烯,故B正确;
C、氯气与水反应生成次氯酸和盐酸,次氯酸分解产生盐酸和氧气,浓盐酸与二氧化锰反应生成氯气,故C正确;
D、碳不完全燃烧生成一氧化碳,一氧化碳继续燃烧生成二氧化碳,二氧化碳与镁反应生成氧化镁和单质碳,故D正确;
故选A.
点评:本题考查物质的性质和制备,题目难度不大,学习中注重常见物质的性质的积累.

练习册系列答案
 口算题天天练系列答案
口算题天天练系列答案
相关题目
乙醇(CH3CH2OH)和二甲醚(CH3-O-CH3)互为的同分异构体的类型为( )
| A、碳链异构 | B、位置异构 |
| C、官能团异构 | D、顺反异构 |
用浓硫酸可以干燥的气体是( )
| A、氨气 | B、硫化氢 |
| C、碘化氢 | D、氧气 |
下列书写的离子方程式中,正确的是( )
| A、高锰酸钾溶液与乙二酸(草酸)反应:2MnO4-+5C2O42-+16H+→2Mn2++10CO2↑+8H2O |
| B、在NH4HSO4溶液中慢慢滴入等物质的量的NaOH溶液:NH4++OH-→NH3?H2O |
| C、VO2+与酸性高锰酸钾溶液反应:5VO2++MnO4-+H2O→5VO2++Mn2++2H+ |
| D、Fe2+离子被空气氧化:4Fe2++O2+2H2O→4Fe3++4OH- |
室温下,下列各组粒子在指定溶液中一定能大量共存的是( )
| A、pH=0的溶液中:K+、ClO-、CH3CHO、SO42- |
| B、Ba(OH)2溶液中:K+、AlO2-、NO3-、Na+ |
| C、加人KSCN显血红色的溶液中:I-、NO3-、SO42-、Fe2+ |
| D、常温下由水电离出的C(H+)=10-10mol?L-1的溶液:Na+、Mg2+、SO42-、Cl- |
如图所示的实验操作,能达到相应目的是( )
A、 干燥Cl2 |
B、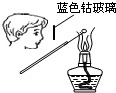 检验Na2CO3中Na+ |
C、 证明氨气极易溶于水 |
D、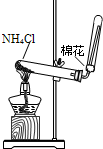 实验室制氨气 |
甲苯被式量为43的烃基取代一个氢原子后,可能得到的物质有多少种( )
| A、8种 | B、6种 | C、9种 | D、12种 |