题目内容
(2011?临沂模拟)已知A、B两种气体在一定条件下可发生反应:2A+B=C+3D+4E.现将相对分子质量为M的A气体mg与适量的B充入一个密闭容器内,恰好完全反应,有少量液滴生成,在相同的温度下测得反应前后压强分别为6.06×106和1.01×107Pa,又测得反应共放热Q kJ,下列说法正确的是( )
分析:首先要弄清物质的聚集状态,求出反应热,根据反应前后气体的压强关系判断反应后气体的总物质的量,进而推断物质的聚集状态;根据一定物质的量的物质反应放出的热量计算反应热,并书写化学方程式.
解答:解:因为A、B是气体,依据题意,设2molA和1molB反应生成的气体的总物质的量为a mol,有3:a=6.06×106:1.01×107,得a=5,即反应式生成物中气体分子的化学计量数之和为5.代入方程式可知,D为液体,C、E为气体,故A、B错误,C正确;
又由A为
mol时,反应放出的热量为Q kJ,故该反应的热化学方程式为:2A(g)+B(g)=C(g)+3D(l)+4E(g);△H=-
kJ/mol,故D错误.
故选C.
又由A为
| m |
| M |
| 2MQ |
| m |
故选C.
点评:本题考查热化学方程式,该题的关键思路是根据反应前后的压强变化的量,根据压强之比等于物质的量之比来判断物质的聚集状态.

练习册系列答案
相关题目
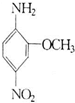 (2011?临沂模拟)2一氨基一5一硝基苯甲醚俗称红色基B,主要用于棉纤维织物的染色,也用于制金黄、枣红、黑等有机颜料,其结构简式如右所示.若分子式与红色基B相同,且氨基(-NH2)与硝基(-NO2)直接连在苯环上并呈对位时的同分异构体数目(包括红色基B)可能为( )
(2011?临沂模拟)2一氨基一5一硝基苯甲醚俗称红色基B,主要用于棉纤维织物的染色,也用于制金黄、枣红、黑等有机颜料,其结构简式如右所示.若分子式与红色基B相同,且氨基(-NH2)与硝基(-NO2)直接连在苯环上并呈对位时的同分异构体数目(包括红色基B)可能为( )