题目内容
【题目】某强酸性溶液X含有Ba2+、Al3+、NH4+、Fe2+、Fe3+、CO32-、SO32-、SO42-、Cl-、NO3-中的一种或几种,取该溶液进行连续实验,实验内容如下:
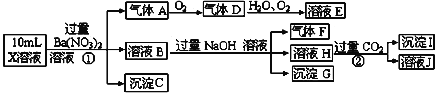
根据以上信息,回答下列问题:
(1)配平①中反应的离子方程式: Fe2+ +H+ +NO3- ===Fe3+ +NO↑+H2O ____
(2)上述离子中,溶液X中除H+外还肯定含有的离子是____,不能确定是否含有的离子是__,若要确定其中阳离子的存在,最可靠的化学方法是____。
(3)沉淀G的化学式为____,写出生成沉淀I的离子方程式____。
(4)假设测定A、F、I均为0.01mol,10ml X溶液中n(H+)=0.04mol,当沉淀C物质的量为0.07mol,能说明(2)中不能确定的阴离子存在的理由是____。
【答案】 3Fe2++4H++1NO3- ===3Fe3++1NO↑+2H2O Fe2+、NH4+、Al3+、SO42- Fe3+、Cl- 取原溶液少量于试管中,滴入几滴KSCN溶液,若溶液变为红色,则证明含有Fe3+,反之则无 Fe(OH)3 AlO2-+CO2+2H2O ===Al(OH)3↓+HCO3- 由题意可知,NO、NH3、Al(OH)3均为0.01mol,则溶液中含有Fe2+0.03mol,NH4+为0.01mol,Al3+为0.01mol,H+为0.04mol,则正电荷为0.14mol,而SO42-为0.07mol,则负电荷为0.14mol,电荷恰好守恒。若(2)中检验出含有Fe3+,则一定含有Cl-,若检验没有Fe3+,则一定不含Cl-
【解析】本题主要考查离子反应。
(1)配平①中反应的离子方程式:3Fe2++4H++1NO3- ===3Fe3++1NO↑+2H2O。
(2)强酸性溶液中H+、CO32-,H+、SO32-发生反应,肯定不存在CO32-、SO32-。上述溶液中加入Ba(NO3)2溶液,产生NO气体,表明溶液含有NO3-和还原性离子Fe2+。生成硫酸钡沉淀,表明溶液含有SO42-。同时排除与SO42-发生反应的Ba2+。在过量NaOH溶液作用下产生氨气,表明溶液含有NH4+。在过量CO2作用下产生的沉淀是Al(OH)3,表明溶液含有Al3+。因此,上述离子中,溶液X中除H+外还肯定含有的离子是Fe2+、NH4+、Al3+、SO42-,不能确定是否含有的离子是Fe3+、Cl-,若要确定其中阳离子的存在,最可靠的化学方法是取原溶液少量于试管中,滴入几滴KSCN溶液,若溶液变为红色,则证明含有Fe3+,反之则无。
(3)沉淀G的化学式为Fe(OH)3,生成沉淀I的离子方程式:AlO2-+CO2+2H2O ===Al(OH)3↓+HCO3-。
(4)假设测定A、F、I均为0.01mol,10ml X溶液中n(H+)=0.04mol,当沉淀C物质的量为0.07mol,能说明(2)中不能确定的阴离子存在的理由是:由题意可知,NO、NH3、Al(OH)3均为0.01mol,则溶液中含有Fe2+0.03mol,NH4+为0.01mol,Al3+为0.01mol,H+为0.04mol,则正电荷为0.14mol,而SO42-为0.07mol,则负电荷为0.14mol,电荷恰好守恒。若(2)中检验出含有Fe3+,则一定含有Cl-,若检验没有Fe3+,则一定不含Cl-。

 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案