题目内容
1.(1)现有浓度均为0.1mol•L-1的下列溶液:①硫酸 ②醋酸 ③氢氧化钠 ④氯化铵
这四种溶液中由水电离出的H+浓度由大到小的顺序是(填序号)④②③①.若将③和④等体积混合后,混合液中各离子浓度由大到小的顺序是c(Cl-)=c(Na+)>c(OH-)>c(NH4+)>c(H+).
(2)100℃时,水的离子积为Kw=1×10-12,在该温度下,将pH=9的NaOH溶液与pH=4的硫酸溶液混合(设混合后溶液的体积为原两溶液体积之和),若所得混合溶液pH=7,则NaOH溶液与硫酸溶液的体积比为1:9.
(3)已知:常温下,酸溶液HR的pH=a,碱溶液MOH的pH=b,且a+b=14,两者等体积混合后溶液显碱性.则混合溶液中必定有一种离子能发生水解,该水解反应的离子方程式为M++H2O?MOH+H+.
(4)在25℃下,将a mol•L-1的氨水与0.01mol•L-1的盐酸等体积混合,反应后溶液中c(NH4+)=c(Cl-),则溶液显中性(填“酸”、“碱”或“中”);用含a的代数式表示NH3•H2O的电离常数Kb=$\frac{1{0}^{-9}}{a-0.01}$,.
分析 (1)酸或碱抑制水电离,含有弱根离子的盐促进水电离;③和④等体积混合后,溶液溶质为NaCl和NH3.H2O,从电离角度进行分析;
(2)设出氢氧化钠溶液为x和硫酸溶液的体积为y,所得混合溶液pH=7,根据水的离子积生成碱溶液中氢氧根离子浓度、酸溶液中氢离子浓度及反应后溶液中氢氧根离子浓度,根据题中数据列式计算出体积之比;
(3)若A的化学式为HR,B的化学式为MOH,且a+b=14,两者等体积混合后溶液显碱性.说明碱是弱碱;
(4)在25℃下,平衡时溶液中c(NH4+)=c(Cl-)=0.005mol/L,根据物料守恒得n(NH3.H2O)=(0.5a-0.005)mol/L,根据电荷守恒得c(H+)=c(OH-)=10-7mol/L,溶液为中性;然后根据NH3•H2O的电离常数进行计算.
解答 解:(1)④氯化铵为强酸弱碱盐,水解促进水的电离,②醋酸为弱酸,溶液中c(H+)较小,①硫酸和③氢氧化钠都为强电解质,浓度相同时,硫酸对水的电离抑制程度较大,所以四种溶液中由水电离出的H+浓度由大到小的顺序是④②③①,
③和④等体积混合后,溶液溶质为NaCl和氨水,溶液呈碱性,故c(OH-)>c(H+),NaCl完全电离,氨水部分电离,NH3•H2O?NH4++OH-,水电离出H+和OH-,故c(Cl-)=c(Na+)>c(OH-)>c(NH4+)>c(H+),
故答案为:④②③①;c(Cl-)=c(Na+)>c(OH-)>c(NH4+)>c(H+);
(2)设氢氧化钠溶液的体积为xL,硫酸溶液的体积为yL,pH=9的NaOH溶液中,氢氧根离子的浓度为:$\frac{1{0}^{-12}}{1{0}^{-9}}$mol/L=10-3mol/L,pH=4的硫酸溶液中氢离子浓度为:10-4mol/L,二者混合后溶液的pH=7,溶液酸性碱性,溶液中氢氧根离子的浓度为:$\frac{1{0}^{-12}}{1{0}^{-7}}$mol/L=10-5mol/L,
说明氢氧化钠过量,则:10-3mol/L×xL=10-4mol/L×y+10-5mol/L(x+y),
解得:x:y=1:9,
故答案为:1:9;
(3)常温下,酸溶液HR的pH=a,碱溶液MOH的pH=b,且a+b=14,两者等体积混合后溶液显碱性.说明碱是弱碱存在电离平衡,则混合溶液中必定是M+离子能发生水解,反应的离子方程式为:M++H2O?MOH+H+,
故答案为:M++H2O?MOH+H+;
M++H2O??MOH+H+( 3分)
(4)在25℃下,平衡时溶液中c(NH4+)=c(Cl-)=0.005mol/L,根据物料守恒得c(NH3•H2O)=(0.5a-0.005)mol/L,根据电荷守恒得c(H+)=c(OH-)=10-7mol/L,溶液呈中性,NH3•H2O的电离常数Kb=$\frac{1{0}^{-7}×5×1{0}^{-3}}{0.5a-5×1{0}^{-3}}$=$\frac{1{0}^{-9}}{a-0.01}$,
故答案为:中;$\frac{1{0}^{-9}}{a-0.01}$.
点评 本题考查了酸碱混合的定性判断、溶液pH的计算、电离平衡常数的计算等知识,题目难度中等,试题知识点较多、综合性较强,充分考查学生的分析能力及灵活应用能力,注意明确溶液酸碱性与溶液pH的关系及计算方法,(4)为难点、易错点,注意明确电离平衡常数的表达式及电荷守恒的应用方法.

| A. | KOH | B. | SO3 | C. | HCl | D. | O3 |
| A. | 正丁烷和异丁烷的熔点、沸点各不相同 | |
| B. | 乙醛和丙烯醛( )与H2充分反应后的产物是同系物 )与H2充分反应后的产物是同系物 | |
| C. | 某有机物燃烧生成等物质的量的CO2和H2O,该有机物的通式一定为CnH2n | |
| D. | 用质谱法测定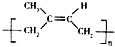 的平均相对分子质量,可得其聚合度 的平均相对分子质量,可得其聚合度 |
| A. | 植物通过光合作用将CO2转化成葡萄糖是太阳能转变成热能的过程 | |
| B. | 油脂属于酯类化合物,油脂可能使溴水褪色 | |
| C. | 萄糖与果糖互为同分异构体,淀粉与纤维素互为同系物 | |
| D. | 油脂、淀粉、蛋白质和维生素等均为高分子化合物 |
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | |||
| 4 | ⑧ | ⑨ |
(2)某元素最高价氧化物的水化物酸性最强,该酸的化学式为HClO4,某元素的气态氢化物水溶液呈碱性,该氢化物的化学式为NH3;
(3)最不活泼的元素,其原子结构示意图为
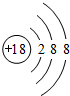 ;
;(4)写出元素④的单质与元素③的最高价氧化物的水化物溶液反应的离子方程式:2Al+2OH-+2H2O=AlO2-+3H2↑;
(5)写出一条能够说明元素⑥的非金属性强于⑤的依据:高氯酸的酸性比硫酸的酸性强.
| A. | 等体积的甲烷与氯气在光照条件下的取代反应 | |
| B. | 丙烯与氯化氢的加成反应 | |
| C. | CH3-CH(OH)-CH3在浓硫酸作用下的消去反应 | |
| D. | 甲苯与液溴在溴化铁做催化剂条件下的取代反应 |
| A. | 需要加热的化学反应都是不自发反应 | |
| B. | 中和反应都是放热反应 | |
| C. | 原电池是将电能转化为化学能的一种装置 | |
| D. | 太阳能电池是将化学能转化为电能的过程 |
| A. | 0.5 L 2 mol•L-1 AlCl3溶液中,Al3+和Cl-总数小于4×6.02×1023个 | |
| B. | 制成0.5 L 10 mol•L-1的盐酸,需要标准状况下的氯化氢气体112 L | |
| C. | 从1 L 1 mol•L-1的NaCl溶液中移取出10 mL溶液,其浓度是1 mol•L-1 | |
| D. | 10 g 98%的硫酸(密度为1.84 g•cm-3)与10 mL18.4 mol•L-1的硫酸的浓度不同 |
 化学是一门以实验为基础的学科.
化学是一门以实验为基础的学科.