题目内容
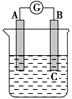
用阳极a和阴极b电解c的水溶液一段时间,然后加入d,能使溶液恢复到电解前状态,a、b、c、d正确组合是( )。
| 选项 | a | b | c | d |
| A | Pt | Pt | NaOH | NaOH |
| B | C | C | NaCl | NaOH |
| C | Cu | Cu | CuSO4 | Cu(OH)2 |
| D | Pt | Pt | H2SO4 | H2O |
D
解析

练习册系列答案
 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案
相关题目
将纯锌片和纯铜片按下图所示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )。
| A.两烧杯中铜片表面均无气泡产生 |
| B.甲中铜片是正极,乙中铜片是负极 |
| C.两烧杯中溶液的酸性均减弱 |
| D.产生气泡的速率甲比乙慢 |
实验发现,298 K时,在FeCl3酸性溶液中加入少量锌粒后,Fe3+立即被还原成Fe2+。某化学兴趣小组根据该实验事实设计了如图所示的原电池装置。下列有关说法中正确的是 ( )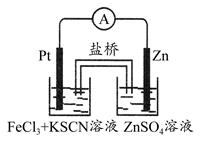
| A.该原电池的正极反应是:Zn-2e-=Zn2+ |
| B.左烧杯中溶液的红色逐渐褪去 |
| C.该电池铂电极上有气泡出现 |
| D.该电池总反应为:3Zn+2Fe3+=2Fe+3Zn2+ |
氯碱工业中关于电极材料的选用,下列说法合理的是 ( )。
| A.两极可用任意可导电固体材料 |
| B.阳极必须用惰性电极 |
| C.阴极必须用惰性电极 |
| D.石墨阳极比金属阳极更节电 |
甲醇燃料电池被认为是21世纪电动汽车的最佳候选动力源,其工作原理如图所示。下列有关叙述正确的是 ( )。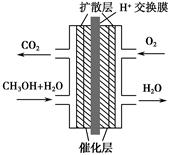
| A.通氧气的一极为负极 |
| B.H+从正极区通过交换膜移向负极区 |
| C.通甲醇的一极的电极反应式为CH3OH+H2O-6e-=CO2↑+6H+ |
| D.甲醇在正极发生反应,电子经过外电路流向负极 |
研究人员研制出一种锂水电池,可作为鱼雷和潜艇的储备电源。该电池以金属锂和钢板为电极材料,以LiOH为电解质,使用时加入水即可放电。关于该电池的下列说法不正确的是( )
| A.水既是氧化剂又是溶剂 |
| B.放电时正极上有氢气生成 |
| C.放电时OH-向正极移动 |
| D.总反应为:2 Li+2H2O=2 LiOH+H2↑ |
电解装置如图所示,电解槽内装有KI及淀粉溶液,中间用阴离子交换膜隔开。在一定的电压下通电,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅。
已知:3I2+6OH-=IO3—+5I-+3H2O
下列说法不正确的是 ( )。
| A.右侧发生的电极反应式:2H2O+2e-=H2↑+2OH- |
| B.电解结束时,右侧溶液中含IO3— |
C.电解槽内发生反应的总化学方程式:KI+3H2O KIO3+3H2↑ KIO3+3H2↑ |
| D.如果用阳离子交换膜代替阴离子交换膜,电解槽内发生的总化学反应不变 |
某同学按如图所示的装置进行电解实验。下列说法正确的是( )。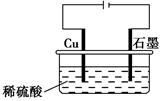
| A.电解过程中,铜电极上有H2产生 |
B.电解初期,主反应方程式为Cu+H2SO4 CuSO4+H2↑ CuSO4+H2↑ |
| C.电解一定时间后,石墨电极上有铜析出 |
| D.整个电解过程中,H+的浓度不断增大 |