题目内容
【题目】现有反应:①Ba(OH)2 8H2O+2NH4Cl═2NH3↑+BaCl2+10H2O,②Fe+H2SO4═FeSO4+ H2↑。试回答下列问题:
(1)两反应中属于吸热反应的是___________(填序号,下同〉,能设计成原电池的是_________。
(2)Fe-Cu原电池的装置如图所示。
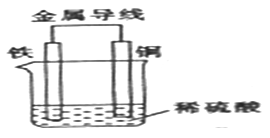
①铁作______(填“正极”或“负极”),溶液中H+向______ (填“铁”或“铜”)电极方向移动。
②正极的现象是___________,负极的电极反应式为____________。
③若反应过程中有0. 2 mol电子发生转移,则生成的氢气在标准状况下的体积为_______L。
【答案】 ① ② 负极 铜 有气泡产生 Fe-2e-=Fe2+ 2. 24
【解析】(1)本题考查常见放热反应,以及原电池的构成,常见吸热反应有多数的分解反应、C和水蒸气、C和CO2的反应、Ba(OH)2·8H2O和NH4Cl的反应、盐类水解等,因此属于吸热反应的是①;构成原电池首先能发生氧化还原反应,①没有化合价的变化,不属于氧化还原反应,不能构成原电池,故①错误;②存在化合价的变化,属于氧化还原反应,能构成原电池,故 ②正确;(2)考查原电池的工作原理和电极反应式的书写,①铁比铜活泼,因此铁作负极,根据原电池工作原理,阳离子向正极移动,因此H+向铜电极移动;②铜极上的电极反应式为2H++2e-=H2↑,铜极上的现象有气泡产生;负极上铁失去电子,即Fe-2e-=Fe2+;③正极上的电极反应是2H++2e-=H2↑,因此转移0.2mol电子,产生氢气的体积为0.2×22.4/2L=2.24L。

练习册系列答案
 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案
相关题目