题目内容
【题目】25℃时,下列各组离子在指定溶液中一定能大量共存的是( )
A. 在强碱性溶液中:Na+、K+、AlO2﹣、Cl﹣
B. pH=l的溶液中:HCO3﹣、NH4+、NO3﹣、Ca2+
C. 无色溶液中:Cu2+、NO3﹣、Cl﹣、H+
D. 无色溶液中:Na+、K+、ClO﹣、SO32﹣
【答案】A
【解析】
A. 在强碱性溶液中四种离子不反应,能大量共存,故正确;B. pH=l的溶液为酸性,HCO3﹣与氢离子反应生成水和二氧化碳,不能共存,故错误;C. Cu2+有颜色,不能在无色溶液中存在,故错误;D. ClO﹣能氧化SO32﹣,不能大量共存,故错误。故选A。

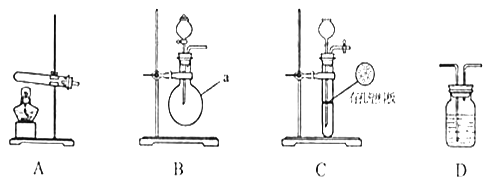
【题目】甲、乙两个研究性学习小组为测定氨分子张氮、氢原子个数比,设计了如下实验流程:

试验中,先用制得的氨气排尽洗气瓶前所有装置中的空气,再连接洗气瓶和气体收集装置,立即加热氧化铜。反应完成后,黑色的氧化铜转化为红色的铜。
下图A、B、C为甲、乙两小组制取氨气时可能用到的装置,D为盛,有浓硫酸的洗气瓶。
甲小组测得:反应前氧化铜的质量为m1 g、氧化铜反应后剩余固体的质量为m2 g生成氮气在标准状况下的体积V1 L。
乙小组测得:洗气前装置D的质量m3 g、洗气后装置后D的质量m4 g、生成氮气在标准状况下的体积V2 L。
请回答下列问题:
(1)写出仪器a的名称:__________________________________。
(2)检查A装置气密性的操作时___________________________________________。
(3)甲、乙两小组选择了不同方法制取氨气,请将实验装置的字母编号和制备原理填写在下表空格中。
实验装置 | 实验药品 | 制备原理 | |
甲小组 | A | 氢氧化钙、硫酸铵 | 反应的化学方程式为______________ |
乙小组 | _____ | 浓氨水、氢氧化钠 | 用化学平衡原理分析氢氧化钠的作用:_____________________________ |
(4)甲小组用所测数据计算出氨分子中氮、氢的原子个数之比为____________________。
(5)乙小组用所测数据计算出氨分子中氮、氢的原子个数比名校小于理论值,其原因是_______________________________ 。为此,乙小组在原有实验的基础上增加了一个装装有药品的实验仪器,重新实验.根据实验前后该药品的质量变化及生成氮气的体积,得出合理的实验结果.该药品的名称是____________________________。